結直腸癌是世界的第四大腫瘤類型,每年導致50萬的患者死亡。從某種程度講,腸癌也是一種富貴病,食用紅肉和脂肪、缺乏運動會明顯地增加罹患腸癌的風險。晚期腸癌患者通過手術治癒的希望不大,唯一有望的是藉助基因測序技術使用恰當的靶向治療、免疫治療來最大化地獲益。
結直腸癌很多是遺傳的,如APC基因突變、DNA錯配修復基因突變的患者(見圖1,與結直腸癌相關的基因突變),一生患結直腸癌的概率非常高,預防結直腸癌一個是做遺傳性結直腸基因檢測,另外是注重生活飲食、每年常規的體檢等。
對於腸癌的精準醫療方面的知識不可能通過一篇文章完全闡釋清楚,該貼的初衷是用來回答一個患者家屬的顧問,結直腸癌的KRAS突變頻率很高,可以像肺癌那樣直接使用下遊的MEK抑製劑嗎?如司美替尼、曲美替尼,如果一個病友這樣做效果好,是不是說明這個方式是合適的,因此我們主要圍繞基因,尤其是KRAS基因來做相應的探尋。
一、結直腸癌的相關基因概覽
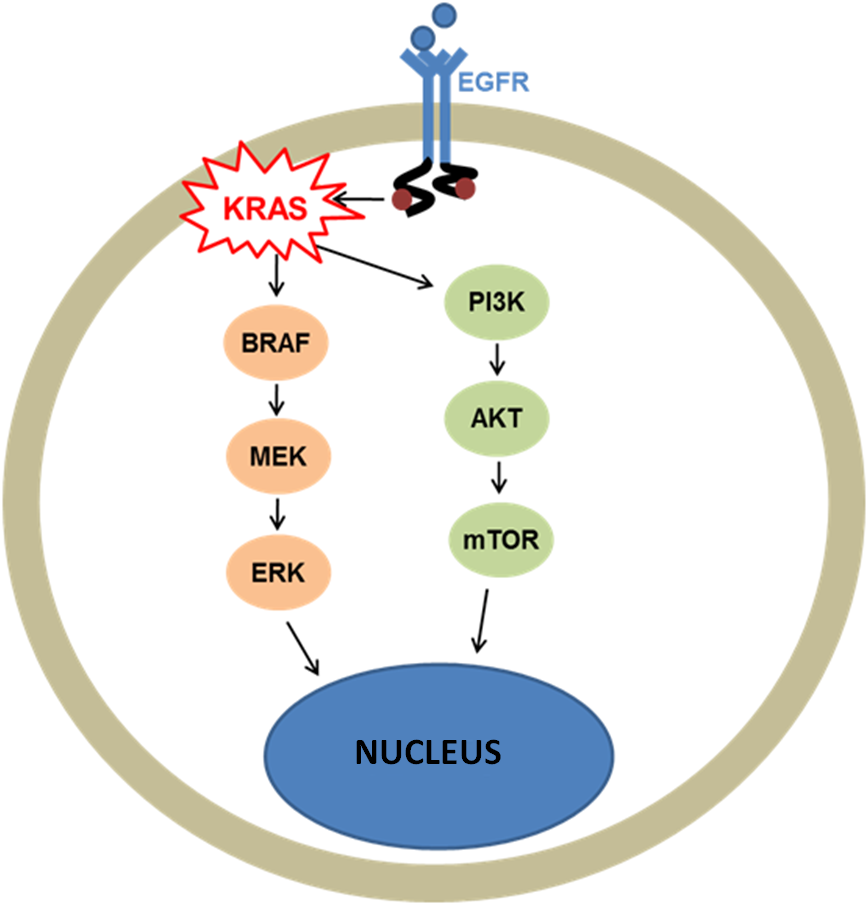
對於結直腸癌的分子遺傳變異的介紹,我們從多個文獻綜合出了一個圖表,展示出來給大家,需要注意的是這個圖表闡釋的一些基因並沒有包含全面,如EGFR、PIK3CA等。但是一些中心的基因如KRAS、BRAF,以及遺傳易感基因都在這裡了。詳細請見下圖1.

圖1:結直腸癌相關的原癌基因、抑癌基因及其生物學功能
二、腸癌的RAS基因突變
腸癌中一個比較關鍵的基因是KRAS基因,KRAS的第二號外顯子突變存在於45%的結直腸癌中,涉及到腫瘤的發生、增殖和進展等。KRAS的其他外顯子突變、NRAS等突變也佔了10%的比例。目前的臨床研究證實,存在RAS突變的腸癌患者不能從EGFR靶點的靶向治療中受益,不論是EGFR的單抗西妥昔單抗、帕尼單抗,還是小分子酪氨酸酶抑製劑,如厄洛替尼、吉非替尼這些。
KRAS在腸癌的突變頻率很高,針對該基因的靶向治療是一個美麗的理想。但是直接抑製KRAS蛋白比較困難:
-
第一是KRAS蛋白和GTP結合的比較緊密,而且二者經常處於一種結合狀態;
第二是KRAS的活性位點缺乏像是口袋一樣的藥物結合區域。
一個變通的方式就是攻擊KRAS基因的下遊,進而阻斷整條信號通路。但是由於信號通路之間的交聯、下遊效應因子的激活、反饋環激活等多種因素(見圖2),單獨抑製MEK某一條信號通路的臨床獲益並不理想。策略是聯合使用靶向MAPK信號通路的多個基因的多種治療藥物,以此來有效地抑製RAS的活性。

圖2:BRAF被反饋後的反饋激活
上面的圖展示的是如果使用某種藥物抑製某個基因,但是腫瘤會進化出一種機制反饋激活上遊的靶點。當然邏輯上講下遊BRAF抑製了,再怎麼激活上遊不也沒有用嗎?其實不是這樣的。即使使用藥物阻斷BRAF,抑製劑也不是把所有的BRAF蛋白的活性都抑製了,另外信號通路之間還有交叉,上遊靶點的替代性高表達、高活性,可以通過其他旁路繞過被抑製的靶點,進而促進腫瘤細胞增殖。
下面有個例子是講的腸癌患者BRAF基因V600E突變使用維羅非尼和上遊的EGFR靶點藥物聯合會較好,單獨抑製BRAF基因則效果不好。

圖3:結直腸癌中MAPK、PI3K和Wnt信號通路的交叉
上面這個圖是腸癌的信號通路,可以看到它們之間存在一定的交叉關係。圖中紅色方框裡是MEK抑製劑,用來對付KRAS或BRAF突變的。但是腫瘤細胞進化出很多方法去激活平行的信號通路來拮抗MEK的抑製。在體外的腸癌細胞或老鼠模型裡證實,存在KRAS或BRAF突變的情況下,不管PI3K信號通路是否激活,如果在抑製MEK的同時,聯合抑製PI3K信號通路,比如使用mTOR抑製劑(藍色方框的藥物),或者PI3K的抑製劑(綠色方框的藥物),或者AKT的抑製劑(黃色方框的藥物MK2206),再或者IGF-1R的抑製劑(粉紅色的方框的藥物OSI-906),也就是在抑製MEK的同時,在任何一個環節去相應地阻斷PI3K信號通路,則可能緩解MEK抑製劑的耐藥性問題。
同時抑製PI3K和MAPK信號通路的臨床I期試驗表明,同時使用兩個信號通路的抑製劑,腸癌患者的腫瘤縮小範圍再2%-64%,呈現出較好的療效。下圖是目前正在開展的一些臨床試驗,特點都是對結直腸癌患者進行雙重抑製。
圖4:正在開展的針對結直腸癌患者雙重抑製的臨床試驗,聯合用藥基本上都涉及對MEK和PI3K信號通路的雙重抑製。
患者和家屬可以跟進一下上圖的臨床試驗,看是否有參加的可能性,後者跟進一下相應的臨床數據,當然「癌度」也會第一時間跟進並給大家報導。
三、腸癌患者不要一直用EGFR的愛必拓
對於RAS野生型的患者而言,進行EGFR靶點的靶向治療,後續會逐漸產生耐葯,耐葯的一大原因也是RAS或BRAF產生了相應的突變。幾個研究表明這一個概率可以高達96%,也就是96%的最初使用西妥昔單抗或帕尼單抗的患者最後會發展出現了KRAS、NRAS、BRAF的突變,這是一個恐怖的數字。
但是2015年的一篇研究發現,如果EGFR靶點的西妥昔單抗導致了KRAS突變的產生,把西妥昔單抗撤掉,則KRAS這一耐葯突變也慢慢消退,腫瘤細胞變得重新對EGFR單抗藥物敏感。這一研究是基於對患者的血漿遊離ctDNA持續健康獲得的,也在後面的第4篇參考文獻裡,有興趣的讀者可以讀一下。

圖5:如果移走EGFR靶點的愛必拓,則KRAS耐葯基因突變也逐漸丟失。
所以,當某個靶向藥物耐葯了,就不要一直再用那個藥物了,這不是簡單地加大計量可以解決的問題,加大計量反而更加促進了耐葯基因突變。相反應該移走耐葯基因的選擇壓。這個道理對於EGFR基因的C797S和T790M順式構型突變是一樣的。需要注意的是,這一思維是文獻的研究,沒有寫到指南裡,臨床上也沒有醫生會這麼用。
四、BRAF基因V600E突變不能隻使用維羅非尼
腸癌患者如果存在BRAF基因V600E的激活突變,使用維羅非尼。因為這個藥物批準用於BRAF基因V600E突變的黑色素瘤患者,所以按照精準醫療的理念,同樣存在BRAF基因V600E的結直腸癌患者應該也用維羅非尼才對。其實往往效果不是很好,因為結直腸癌細胞會反饋激活EGFR靶點,使得儘管存在BRAF抑製劑的情況下,EGFG的激活仍可以驅動腫瘤增殖,如果同時使用上BRAF抑製劑聯合EGFR的抑製劑(西妥昔單抗或吉非替尼、厄洛替尼都行),結果就可以產生協同效應,至於為何維羅非尼在黑色素瘤可以那麼好地抑製BRAF的V600E,原因是黑色素瘤裡的EGFR基因表達量較低,所以反饋激活耐葯不起作用。這一研究是發表在Nature雜誌的研究論文,可不是小雜誌,是讓我自己比較大跌眼鏡的,我一直以為基因突變需要抑製的是下遊,而上遊是沒有必要去管的。

圖6:BRAF和EGFR抑製劑聯合使用,可有效抑製結直腸癌細胞的增殖。
見上圖,WiDr和VACO432是兩種存在BRAF突變的結直腸癌細胞,如果維羅非尼(PLX4032)和吉非替尼、厄洛替尼聯合使用的話,可以導致腸癌細胞的凋亡,降解產生的PARP片段出現。而C和D圖是老鼠的模型裡,西妥昔單抗聯合維羅非尼(PLX4032)可以導致腫瘤細胞縮小。
五、癌度有話說
現在我們回到寫這個文章的初衷,就是結直腸癌患者既然存在那麼高的RAS基因突變,是否可以直接使用AZD6244(司美替尼),或曲美替尼這些MEK抑製劑,如果BRAF突變是否可以直接使用維羅非尼,這在基因檢測報告裡都是會這麼建議的。
如果您通篇看完帖子,應該會理解不是這麼簡單。如果單用MEK抑製劑有效,那麼是屬於幸運,如果無效不敏感,或者可以試試聯合PI3K信號通路的藥物,如mTOR的依維莫司、雷帕黴素等。如果BRAF突變無效,則可以考慮下聯合EGFR靶點的靶向藥物,以解決可能出現的反饋激活的問題,這都是有在進行的臨床試驗,或相應的高水準文獻發布的,可不是瞎胡指揮,如果單獨MEK抑製劑無效了,可以往這兩個方向去思考,但是究竟該聯合哪一種?這個誰也說不情況。
一個方式是儘可能最快捷、準確地判斷出這些信號通路的基因突變情況,包含基因突變、蛋白高表達等,當然這需要及時準確地獲取樣本,使用恰當有效的檢測手段,如果不能實現這一點,就是屬於盲試了,這個需要有一種恰當的監控療效的方式,如腫瘤標誌物,或者影像學指標等。
編者:翱宇
參考文獻:
1、Munteanu I,et al. Journal of Medicine and Life Vol. 7, Issue 4, October-December 2014, pp.507-511.
2、Prahallad A, et al. Nature, 2012 Jan 26;483(7387):100-103.
3、Daniel H Ahn, et al. World J Gastroenterol 2016 July 7; 22(25): 5668-5677.
4、Siravegna G, et al., Nat Med. 2015 Jul;21(7):795-801.
5、Hoeflich, K.P, et al., Cancer Res. 2012, 72, 210–219.
6、Shimizu, T, et al., Clin. Cancer Res.2012, 18, 2316–2325.
原創文章,轉載需授權後註明來源:癌度