6月1日下午,在第十二屆東方心臟病學會議(OCC2018)的心臟急症論壇,廣東省人民醫院薛凌教授結合《2017 AHA科學聲明:心源性休克的當代管理》詳細講解了心源性休克的綜合管理要點。
概念和分型
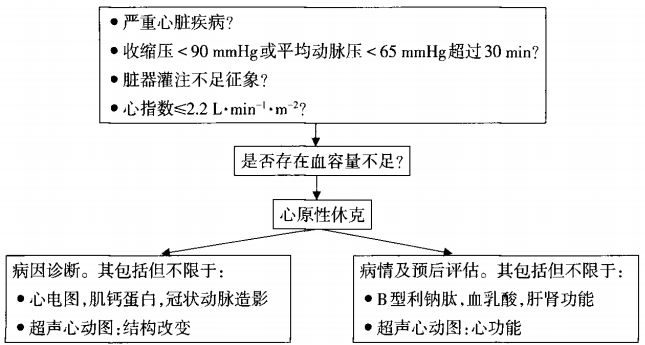
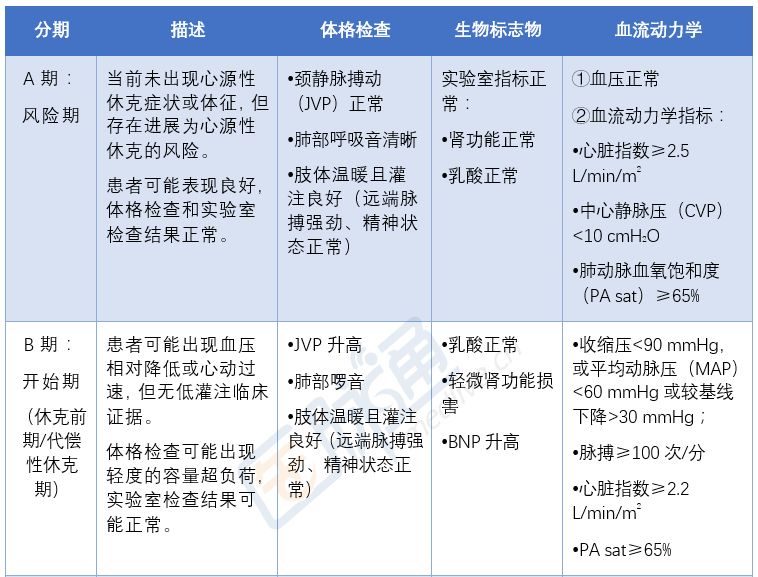
心源性休克(CS)是指心臟原因引起的有效心輸出量下降,導致組織低灌注從而發生臨床和生化改變的一種狀態。其兩大特徵是:(1)容量補充無效的低血壓;(2)嚴重器官低灌注,需要藥物和機械支持。
表1 不同臨床試驗和指南中的CS臨床標準
根據血容量狀態和外周循環將心源性休克分為四種類型,其中2/3的心梗所致心源性休克是濕冷型。

圖1 心源性休克的血流動力學分型
SHOCK註冊人群中,正常血壓(SBP>90 mmHg)的心源性休克佔5.2%。右室相關的心源性休克CVP相對高,PASP相對低。SHOCK研究中,71%的右室梗死患者CVP/PCWP≥0.8。
病因和預後
急性冠脈綜合征(ACS)引起的CS佔81%,5%~12%的ACS合併CS。
其他病因包括心包切開術後低心排、心肌炎、心臟瓣膜病、應激性心肌病和圍產期心肌病等。不同病因誘發的CS,處理策略不盡相同。需及時診斷並啟動針對性治療。
SHOCK研究人群6年病死率為62%,註冊人群1年再入院率為59%。
輔助檢查和危險分層
檢查包括:(1)心肌壞死標誌物;(2)氧代謝狀態:動脈乳酸、混合靜脈血氧;(2)急性腎損傷指標:尿量、肌酐;(3)急性肝損傷指標:AST、ALT、TB、LDH、PT等;(4)心電圖、X光、經胸心臟彩超,必要時經食道心臟超聲。
分層工具:(1)APACHE-III和SAPS-II可用於預測死亡風險;(2)GRACE系統適用於ACS合併CS患者的住院及長期死亡風險預測。
管理流程和治療措施
聲明在心源性休克的救治和管理方面提出了詳細的建議,包括區域醫護體系和管理流程等。

圖2 區域性心源性休克醫護體系

圖3 心源性休克的管理流程
備註:ACS,急性冠脈綜合征;CABG,冠狀動脈旁路移植術;ECMO,體外膜氧合;IABP,主動脈內球囊泵;MCS,機械循環支持;PCI,經皮冠狀動脈介入治療;VAD,心室輔助裝置
1. 再灌注與血運重建
(1)溶栓
STEMI合併CS的患者,如果無法及時接受早期侵入性策略,考慮溶栓治療;溶栓策略制定應個體化。
(2)早期侵入性策略
對ACS合併CS患者給予早期侵入性策略和適當的血運重建,包括不穩定的神經系統狀態以及接受溶栓治療後的患者,無論心梗起病時間;支持ACS合併CS患者採用PCI和CABG進行早期血運重建。
在CULPRIT-SHOCK研究結果之前,對罪犯血管和有血流動力學意義的非罪犯病變同時進行血運重建是合理的。對AMI合併CS多支血管病變或左主乾病變患者,心臟內外科應協同制定個體化的治療方案。
(3)PCI輔助抗栓藥物
無嚴重出血併發症患者,PCI後繼續雙抗治療;當無法口服或者口服吸收存在不確定性,可考慮給予靜脈GP IIb/IIIa抑製劑或者靜脈P2Y12抑製劑坎格雷洛。
CS患者PCI最佳的抗凝方案尚未確定,可選擇比伐盧定、低分子肝素或者普通肝素。如果PCI後需要持續抗凝,由於CS患者存在急性腎損傷高風險,建議首選靜脈應用普通肝素。
2. 重症監護與血流動力學目標
對CS診斷不能確定或者初始治療反映不佳的中重度患者,建議使用PAC進行監測;血流動力學監測要與其他器官灌注指標相結合。最佳的MAP在患者之間存在差異。臨床醫生需要動態綜合分析各項指標。
3. 非血管活性藥物
對於STEMI合併心衰患者以及低心排患者,避免使用β受體阻滯劑,低血壓患者避免使用RAAS抑製劑。
當患者容量狀態優化,停止正性肌力藥物與縮血管藥物至少24h再開始使用β受體阻滯劑是合理的。RAAS抑製劑可與正性肌力並血管擴張藥物聯合用於肺水腫患者。心梗相關的CS患者使用他汀類藥物是合理的。
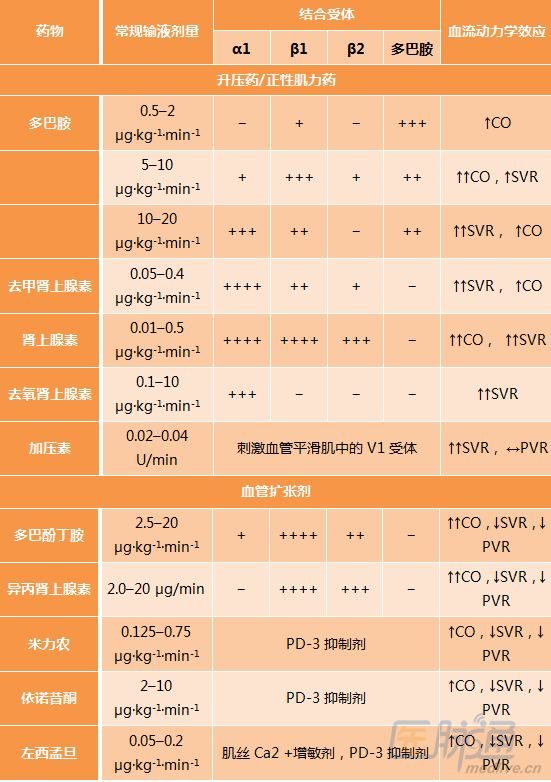
4. 血管活性藥物
最佳的一線血管活性藥物尚不能確定。去甲腎上腺素相關心律失常發生率更低,可能是部分CS患者的首選藥物。
表2 血管活性藥物舉例
5. 機械通氣和循環支持
防範機械通氣相關的血流動力學惡化,包括鎮靜藥物、正壓通氣、迷走刺激的影響。通氣模式與參數設定的目標在於避免低氧血症和高氧,優化血流動力學。
常用經皮機械循環支持裝置包括主動脈內球囊反搏(IABP)、體外膜肺氧合(ECMO)、Tandem Heart和Impella等。