▎醫藥觀瀾/報導
近日,致力於開發、生產和銷售用於治療腫瘤等重大疾病創新藥物的信達生物,在ASCO年會上公布了兩項臨床研究數據。其中一項是中國醫學科學院腫瘤醫院院長赫捷教授牽頭的信迪利單抗用於可切除非小細胞肺癌新輔助治療的臨床研究數據,數據顯示,信迪利單抗在新輔助可切除非小細胞肺癌治療中表現出良好的安全性。另一項是IBI305(貝伐珠單抗生物類似葯)對比原研葯的臨床研究關鍵數據。
1、信迪利單抗(PD-1抑製劑)
根據公告,肺癌是全球目前發病率和死亡率均排名第一的惡性腫瘤,其中非小細胞肺癌(NSCLC)約佔所有肺癌病例80%-85%。通常,可切除的非小細胞肺癌患者會在手術治療後面臨複發困境,迫切需要新的治療方法以改善預後。
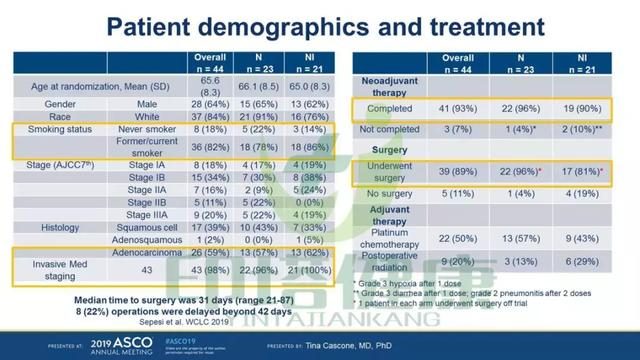
信迪利單抗這項研究(ChiCTR-OIC-17013726)的初步試驗數據以海報的形式對外公布(海報編號 # 8531)。這是一項在中國開展,旨在評估信迪利單抗單藥用於可切除非小細胞肺癌新輔助治療的開放性、單中心、Ib期研究。
數據顯示,比較新輔助治療前後的PET-CT,9例患者的腫瘤代謝攝取值(SUV)降低>30%,其中8例患者同時也達到了主要病理緩解(MPR,活性腫瘤細胞≤10%)。在11例SUV下降未達到30%或SUV上升的患者中無MPR。
術後病理報告顯示,10例患者(45.5%)達到了主要病理緩解(MPR,活性腫瘤細胞≤10%),其中4例患者(18.2%)達到了完全病理緩解(CPR,沒有活性腫瘤細胞)。MPR和SUV降低存在相關性,新輔助治療後PET-CT中SUV的降低可能可以預測術後MPR的情況。
這表明,信迪利單抗用於可切除非小細胞肺癌的新輔助治療顯示出了良好的安全性數據。
信迪利單抗是信達生物和禮來在中國共同合作研發的PD-1抑製劑,已在中國獲批上市,併入選2019版中國臨床腫瘤學會(CSCO)淋巴瘤診療指南。目前,有超過20多個臨床研究(其中8項是註冊臨床試驗)正在進行,以探討信迪利單抗在其它實體腫瘤上的抗腫瘤作用。
▲圖片來源:123RF
2、IBI305(VEGF抑製劑)
IBI305是貝伐珠單抗的生物類似葯,為重組抗血管內皮生長因子(VEGF)人源化單克隆抗體注射液,用於非小細胞肺癌和結直腸癌等惡性腫瘤。原研葯已被獲批用於治療包括非小細胞肺癌在內的多個惡性腫瘤,其顯著的療效和良好的安全性已得到普遍認可。
此次亮相ASCO年會的研究(NCT02954172)以海報的形式公布,該研究由中山大學附屬腫瘤醫院內科主任張力教授團隊牽頭完成,是一項針對晚期非鱗非小細胞肺癌患者的多中心、隨機、雙盲、平行、陽性對照3期研究,旨在評估相比於原研葯貝伐珠單抗,IBI305一線治療晚期非鱗非小細胞肺癌患者的療效和安全性。
研究共入組450例患者,其中IBI305組共有224例患者。結果顯示,IBI305組的ORR為44.3%(98/221),貝伐珠單抗組的ORR為46.4%(102/220),風險比0.95(90% CI: 0.803, 1.135);在中位無進展生存期(PFS)方面,IBI305組為7.9個月,貝伐珠單抗組為7.8個月,兩組的緩解持續時間(DoR)也非常近似;治療期不良事件(TEAEs)可控,且與貝伐珠單抗已知的不良事件一致。
這表明,IBI305對比原研藥用於治療晚期非鱗非小細胞肺癌患者具有類似的有效性和安全性。早些時候,信達生物還宣布IBI305用於晚期非鱗非小細胞肺癌患者3期臨床研究(CIBI305A301)和健康受試者葯代動力學研究(CIBI305A201),均達到預設的主要研究終點。
目前,國內還沒有獲批上市的貝伐珠單抗生物類似葯。而IBI305的新葯上市申請已被國家藥品監督管理局受理,並被納入優先審評。作為潛在的貝伐珠單抗生物類似葯,IBI305的獲批上市將提高藥物可及性,造福更多的患者。
除了肺癌,信達生物還開展了IBI305在肝癌方面的探索。今年2月,IBI305聯合信迪利單抗用於一線肝細胞癌的臨床研究(ORIENT-32)完成首例患者給葯。根據信達公告,原發性肝癌是我國發病率第四位、死亡率第二位的惡性腫瘤,五年生存率僅10%左右,只有約20%-30%患者有手術的機會。
長按掃碼關注「醫藥觀瀾」微信公眾號,了解更多中國醫藥創新動態。
參考資料:
[1]【ASCO】中國醫學科學院腫瘤醫院院長赫捷教授牽頭的信迪利單抗用於可切除非小細胞肺癌新輔助治療的臨床研究數據公布,Retrieved Jun 3, 2019 from 信達生物官網
[2]對比原研葯,信達生物公布IBI305(貝伐珠單抗生物類似葯)的臨床研究關鍵數據,Retrieved Jun 3, 2019 from 信達生物官網