專欄特約撰稿專家:山東大學齊魯醫院 唐夢熊
唐夢熊副主任醫師
本期話題:心源性休克
心源性休克是指充分糾正前負荷不足等情況下,因心輸出量明顯減少而致組織器官灌注不足的臨床綜合征。儘管急性心肌梗死死亡率已顯著降低,心源性休剋死亡率仍高達40%~60%。
診斷標準
null
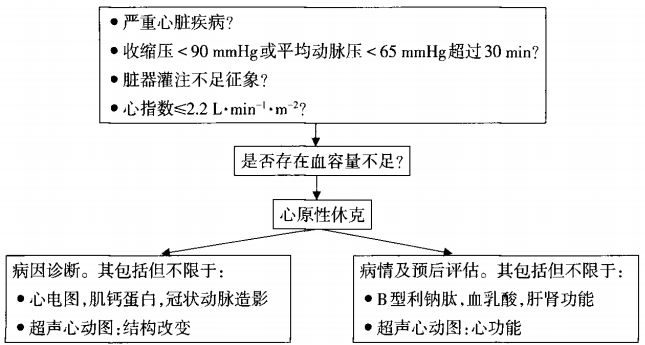
心源性休克主要表現為持續低血壓和組織灌注受損。
其臨床診斷標準為
合併嚴重心功能障礙,且排除其他低血壓原因(如低血容量、出血、敗血症、肺栓塞、心包填塞、主動脈夾層或先前存在的瓣膜病);
臨床表現為
持續性低血壓:收縮壓<90 mmHg,或平均動脈壓自基線下降≥30 mmHg,持續時間>30分鐘;或需使用血管升壓藥物維持血壓在90 mmHg以上;
器官灌注受損體征(至少一項):精神狀態改變;皮膚濕冷;少尿;血清乳酸水準升高;
血流動力學指標為:無循環支持情況下心臟指數≤1.8 L/(min?m2),有循環支持的情況下≤2.0~2.2 L/(min?m2);肺毛細血管楔壓≥15 mmHg。血流動力學檢測不是必須的,但有助於心源性休克的診斷。
病因和病理生理學機制
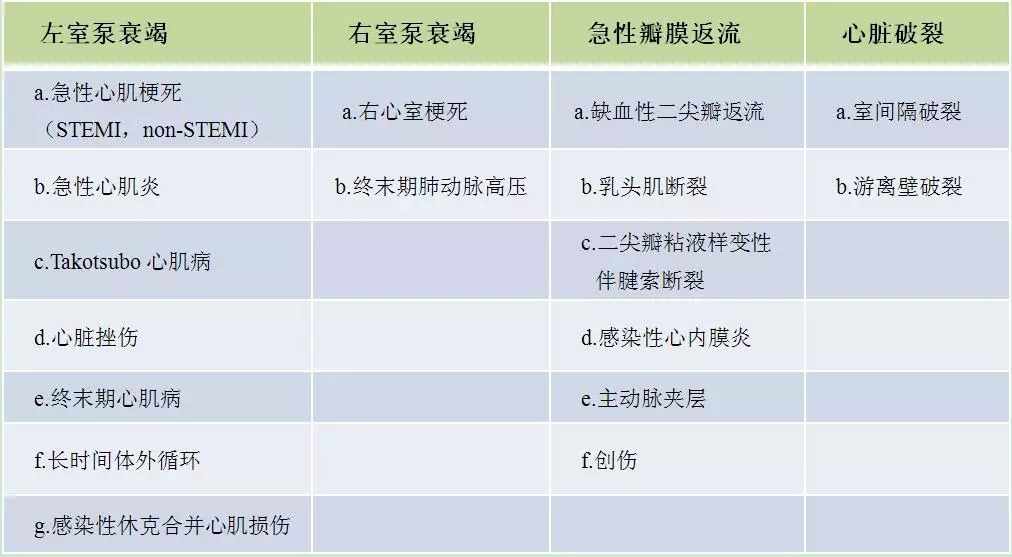
在所有休克中,心源性休克約佔16%。在所有心源性休克中,約70%~80%病因為急性心肌梗死,多見於急性心肌梗死左室質量損失大於40%,或小於40%但合併反覆發生難治性心律失患者。
在急性ST段抬高型心肌梗死中,心源性休克的發生率為5%~8%,在急性非ST段抬高型心肌梗死中心源性休克的發生率約為2.5%。
表1 心源性休克常見病因分類
null
(點擊可查看大圖)
心源性休克始於心臟,波及全身。心肌收縮功能受損導致潛在的螺旋式的心輸出量減少、血壓下降,後者促進冠狀動脈缺血,繼而導致心功能進一步下降。
心輸出量降低可以導致急性和亞急性循環系統紊亂,包括外周血管、肢體及重要器官灌注不足。而外周循環失代償進一步促進休克發展。
外周血管收縮儘管增加冠狀動脈和其他重要臟器灌注,但也導致心臟後負荷增加。
此外,急性心肌損傷誘發系統性炎症,炎症介質如內皮原性誘導性一氧化氮合酶、白介素、腫瘤壞死因子等釋放增加,可引起病理性血管擴張,促進心源性休克的進程。最終導致多臟器功能衰竭,甚至死亡。
監測指標
null
在休克的監測中,氧供給和需求矛盾是休克最主要的矛盾,氧供給取決於心輸出量和氧含量,即DO2 =CO×CaO2(DO2:氧供給;CO:心輸出量;CaO2:氧含量),而心輸出量為心率和每搏輸出量的乘積。監測的指標主要圍繞這一對矛盾。
此外,如何平衡心臟前後負荷也是心源性休克處理的關鍵問題,因此,反映心功能的心輸出量和反映心臟左室充盈壓的肺毛細血管楔壓是我們臨床實踐中最重要的兩個監測參數。臨床上,肺部濕羅音、頸靜脈充盈、血管充盈(X光)=「充血」=PCWP增高;皮膚低溫(和濕冷不同)=CO下降。
臨床監測的指標包括
無創監測:包括生命體征、皮膚溫度與色澤、尿量和精神狀態、脈氧飽和度、心臟超聲等;
實驗室監測:包括血氣分析、肝腎功能、乳酸、心肌損傷標誌物、BNP/NT-proBNP等;
有創監測:包括中心靜脈壓(CVP)、動脈內血壓、漂浮導管等。
處 理
null
心源性休克是一種時限性危重症,患者死亡高峰主要在發病48小時內,因此,快速診斷,及時病因處理,早期穩定血流動力學,防治靶器官損害,是心源性休克處理的基本原則。本文主要介紹血流動力學支持治療現狀。
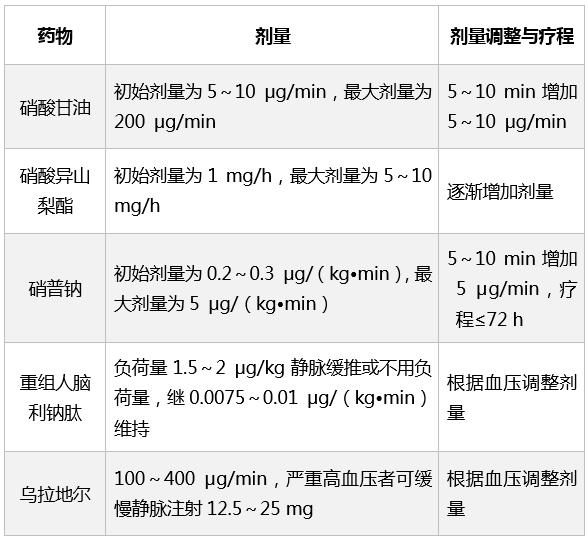
藥物治療
血流動力學支持藥物治療包括正性肌力作用藥物和縮血管藥物,它們是心源性休克救治過程中不可缺少的重要手段。
其中具有代表性,臨床常用的藥物有:去甲腎上腺素、多巴胺、多巴酚丁胺。
正性肌力藥物和血管收縮藥物廣泛用於改善血流動力學,可改善血流動力學,但常伴隨顯著的副作用,長時間大劑量升壓和/或正性肌力藥物甚至可能增加死亡率或不改善死亡率。
正性肌力作用藥物在增加心肌收縮力的同時也增加心肌氧耗;縮血管藥物可使阻力血管收縮從而增高血壓,但也使組織灌注減少,增加組織缺血的風險。
因此,正性肌力作用藥物和縮血管藥物均應盡量使用最小的有效劑量,在增加心肌收縮力和加重心肌氧耗,增加外周血管阻力和增加組織灌注壓之間尋求最佳平衡點。
有研究表明,和使用去甲腎上腺素比較,心源性休克患者接受多巴胺治療患者心律失常發生率和死亡率增加,推測與去甲腎上腺素對心肌無正性肌力作用有關,目前各指南推薦心源性休克應首先使用去甲腎上腺素來維持有效灌注壓,但從循證醫學的角度仍需要對不同表型患者作進一步的驗證。
多巴酚丁胺對心肌正性肌力作用較明顯,且能降低血管阻力,引起血壓輕度下降,因此被推薦用於心源性休克時低心排血量的治療。
磷酸二酯酶抑製劑或左西孟坦不作為一線用藥。磷酸二酯酶抑製劑改善血流動力學,但增加患者死亡率。左西孟旦改善血流動力學和心功能,但不能增加患者存活率。
硝酸脂類製劑雖然可改善微循環,但導致血壓下降,不宜使用。
表2 常用升壓/正性肌力藥物臨床藥理特點

null
(點擊可查看大圖)
非藥物治療
無創通氣
無創通氣可以顯著改善呼吸困難和低氧血症,以及與它們相關的代謝紊亂,其對死亡率的影響尚不清楚。
心源性休克患者大多數需要有創機械通氣,但目前沒有充足的證據推薦特定的通氣模式、策略。對於左室負荷過重的患者,機械輔助通氣可增高功能殘氣量,升高氣道內壓和胸腔內壓力,靜脈回心血量減少,從而達到降低左室前負荷,改善低氧血症的目的。
主動脈內球囊反搏(IABP)
主動脈內球囊反搏(IABP)通過物理作用,提高主動脈內舒張壓,增加冠狀動脈供血和改善心肌功能,可提高心臟指數0.5~1 L/(min?m2)。它可明顯增加冠狀動脈的血流灌注,降低急性心肌梗死並發室間隔穿孔和乳頭肌功能不良的反流量和分流量,使心臟前向射血增加,如果聯用正性肌力藥物和血管擴張劑則效果更為顯著。目前臨床應用逐漸廣泛,已經成為急性心肌梗死並發心源性休克的常規治療手段。
體外膜肺氧合(ECMO)
體外膜肺氧合(ECMO)是一種短期呼吸替代兼有循環輔助功能的裝置,常見形式有兩種:靜脈-動脈(VA型)和靜脈-靜脈(VV)型。VV型適合呼吸衰竭,VA型適合心源性休克患者。目前尚無隨機研究或Meta分析證實ECMO改善休克患者預後。但有觀察性研究發現,ECMO可改善心源性休克患者微循環。推薦用於經兩種大劑量血管收縮/正性肌力藥物和IABP仍無效的患者。
左室輔助裝置(LVAD)
左室輔助裝置(LVAD)將左心房或左心室血流引入輔助泵體,經泵體驅動血流進入主動脈,完全替代左心泵血功能其效能較IABP高6~8倍,目前泵血能力可達到2.5~5 L/min,可降低左心室室內張力降可低80%,心肌氧需求降低40%。目前LAVD有三種:左室-主動脈裝置,包括Impella 2.5 和Impella CP;左房-主動脈裝置TandemHeart。小規模研究認為,LVADs較IABP改善血流動力學參數,但Meta分析並未發現二者30天對存活率的差異。
心源性休克的處理可以理解為:一個中心,兩個基本點:中心即為心肌保護,基本點分別為藥物血流動力學支持和循環輔助支持。
血運重建可降低心肌梗死患者心源性休克的死亡率;
藥物治療改善血流動力學,但無隨機研究證實改善死亡率;
機械輔助裝置改善血流動力學優於藥物治療,但目前併發症發生率仍較高,儘管小規模研究發現ECMO改善心源性休克患者死亡率,但包括ECMO在內其他機械輔助裝置均缺乏隨機對照研究其對生存率的影響。