不想錯過界哥的推送?
並點擊右上角「···」菜單,選擇「設為星標」

在今年的美國臨床腫瘤學會(ASCO)年會上,IMpassion130研究第二次總生存期(OS)中期分析數據表明:在PD-L1陽性患者中,Atezolizumab +白蛋白紫杉醇組中位OS為25個月 ,達到7個月的顯著改善,且安全性可控患者自評結果表明:Atezolizumab +白蛋白紫杉醇組是可耐受的,且對比安慰劑組一線治療轉移性三陰性乳腺癌(TNBC)在不損害健康相關生命質量(HRQoL)、身體和社會功能的情況下具有臨床獲益[3]。整體回顧研究設計
-
組織學確診為轉移性或者不可切除的TNBC,有組織標本可進行PD-L1表達檢測(SP142檢測),既往接受紫杉類單葯,且既往在轉移性TNBC階段未接受過化療或靶向治療;允許患者在輔助治療階段接受過放療和化療(包括紫杉類),但要求距離上次治療的時間≥12個月。
-
入組患者按1:1隨機分配接受Atezolizumab聯合白蛋白紫杉醇或安慰劑聯合白蛋白紫杉醇。Atezolizumab的給藥劑量為840mg,靜脈用藥,第1、15天用藥,白蛋白紫杉醇為100mg/m2,靜脈用藥,第1、8和15天用藥,每28天為一個周期。
-
分層因素為是否合併肝轉移、是否接受過新輔助或輔助治療、腫瘤浸潤免疫細胞的PD-L1表達(PD-L1<1% vs ≥1%)。
主要終點為研究者評估的無進展生存期(PFS)和OS,包括意向性治療(ITT)人群和PD-L1≥1%的患者亞組。次要終點包括客觀緩解率(ORR)、緩解持續時間(DOR)和安全性。

圖1 IMpassion130研究設計
研究結果 中位PFS[4]
ITT人群:Atezolizumab 組對比安慰劑組,PFS顯著延長,中位PFS分別為7.2個月和5.5個月,分層HR 0.8,95%CI:0.69-0.92,P=0.002;PD-L1陽性亞組:Atezolizumab聯合組對比安慰劑組進展或死亡風險顯著降低,中位PFS分別為7.5個月和5.0個月,HR 0.62,95%CI:0.49-0.78,P<0.001;1年的PFS率,Atezolizumab組高於安慰劑組,分別為29.1%和16.4%。
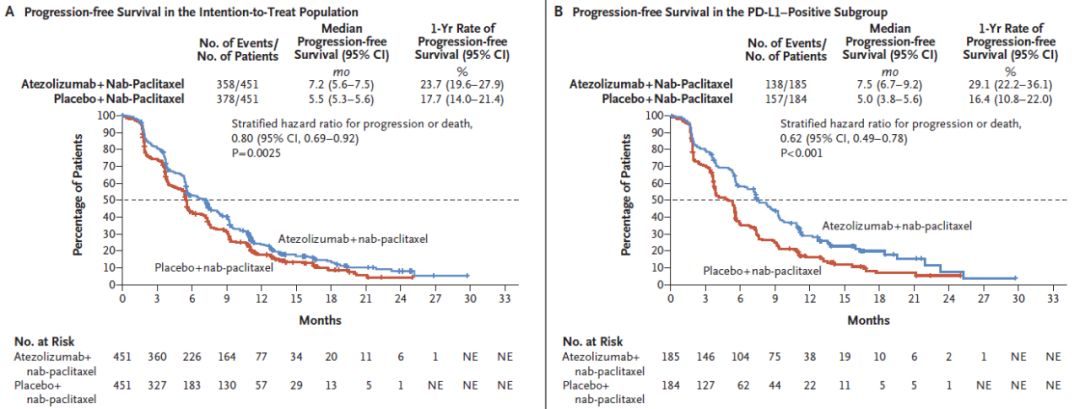
圖2 兩組PFS結果
中位OS(第一次和第二次中期分析)[1,4]第二次中期分析OS數據表明:在ITT人群中,OS未觀察到顯著統計學差異,但在PD-L1陽性患者中,Atezolizumab +白蛋白紫杉醇組對比安慰劑+白蛋白紫杉醇組,中位OS分別為 25個月和18個月,HR 0.71,95% CI: 0.54-0.93,有 7個月的顯著改善[1]。
圖3 第二次OS中期分析結果(ASCO 2019)

圖4 第一次OS中期分析結果
■ 次要研究終點
在ITT人群中,Atezolizumab組和安慰劑組的ORR分別為 56.0%和45.9%,中位DOR分別為 7.4個月和5.6個月;PD-L1亞組中,兩組的ORR分別為58.9%和42.6%,中位DOR分別為 8.5個月和5.5個月[4]該項研究表明,在TNBC患者中PD-L1陽性表達主要在腫瘤浸潤免疫細胞中,並且進一步發現免疫細胞PD-L1陽性對Atezolizumab 組具有較高的預測作用,而BRCA1/2突變狀態不影響最終的獲益情況[5]。安全性-
Atezolizumab +白蛋白紫杉醇組與安慰劑+白蛋白紫杉醇組的特別關注的不良事件發生率分別為:58%和42%[2];
-
Atezolizumab +白蛋白紫杉醇組與安慰劑+白蛋白紫杉醇組中皮疹、甲減、甲亢以及肺炎的發生率不同,分別為:34% vs 26%;18% vs 5%;5% vs 1%;4% vs <1%;導致用藥終止的起因為外周神經病變[2];
特別關注的不良反應發生的中位時間與之前的Atezolizumab單葯試驗結果一致。
總結
IMpassion130研究第2次中期分析的結果與第1次一致,進一步確認在初治PD-L1陽性轉移性TNBC患者中,Atezolizumab+白蛋白紫杉醇可取得有臨床意義的OS獲益。?
參考文獻
[1]IMpassion130: updated overall survival (OS) from a global, randomized, double-blind, placebo-controlled, Phase III study of atezolizumab (atezo) + nab-paclitaxel (nP) in previously untreated locally advanced or metastatic triple-negative breast cancer (mTNBC).J Clin Oncol 37, 2019 (suppl; abstr 1003).
[2]IMpassion130: Expanded safety analysis from a P3 study of atezolizumab (A) + nab-paclitaxel (nP) in patients (pts) with treatment (tx)-na?ve, locally advanced or metastatic triple-negative breast cancer (mTNBC).J Clin Oncol 37, 2019 (suppl; abstr 1068).
[3]Patient-reported outcomes (PROs) from the phase III IMpassion130 trial of atezolizumab (atezo) plus nabpaclitaxel (nP) in metastatic triple-negative breast cancer (mTNBC).J Clin Oncol 37, 2019 (suppl; abstr 1067).
[4]Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2018 Nov 29;379(22):2108-2121.doi:10.1056/NEJMoa1809615.
[5]IMpassion130: Efficacy in immune biomarker subgroups from the global, randomized, double-blind,placebo-controlled, phase III study of atezolizumab + nab-paclitaxel in patients with treatment na?ve,locally advanced or metastatic triple-negative breast cancer. SABCS 2018.