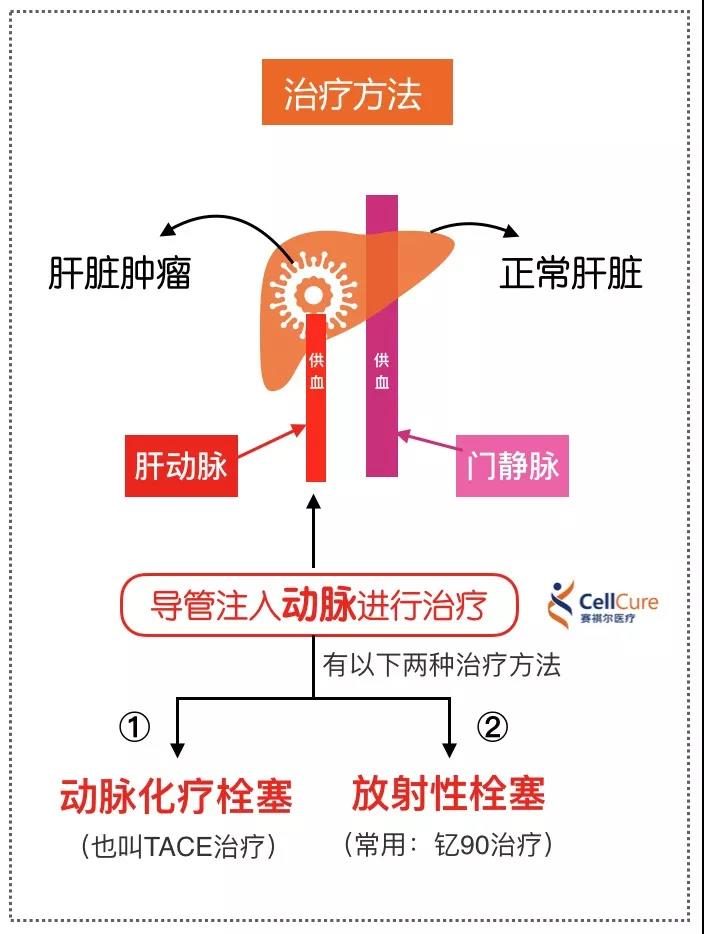
胸部惡性腫瘤放射治療在獲得良好療效的同時也引起了一些嚴重乃至致命的併發症,如放射性肺炎。肺是放射線敏感器官,放射性肺炎是胸部惡性腫瘤患者接受放療或同步放化療後最常見的劑量限制性毒性之一。放射性肺炎限制了臨床使用更高、更有效地照射劑量以及聯用其他方法治療腫瘤,並且嚴重影響了患者的生活質量和生存期,嚴重的放射性肺炎可危及生命。今天就發病因素、病理、臨床表現、治療及預防等方面,對放射性肺炎作一概述。病例簡介
王某,男,70 歲,慢性支氣管炎、肺氣腫病史 10 余年,發現右肺小細胞肺癌 10 個月,化療 6 周期後開始放療,擬定劑量為 50-56 Gy。
當放療至 31d,劑量 44 Gy/22f 時患者出現咳嗽,活動後胸悶,行肺部 CT 示左肺上葉前段及左下肺均見片狀高密度,邊緣模糊影,診斷為放射性肺炎。
給予地塞米松、抗生素等治療,當日縮小照射野,休息 3d,又行放療 3 次直至 50 Gy/25f 的根治量方結束放療。出院後十天既有咳嗽,氣短,入住呼吸科。
肺 CT 示右肺中下葉大片狀模糊陰影,診斷為放射性肺炎, 立即給予甲強龍 80 mg/d,1w 後改為 40 mg/d 病情未緩解,病人出現少量咯血 (每日 20 ml),用止血藥物後轉為痰中帶血,呼吸困難逐漸加重,呼吸頻率加快 (40 次/min),幾天后達 60 次/min,家屬放棄治療,於回家途中病人死亡。
發病因素放射性肺炎是由炎性因子介導的急性自發性免疫樣反應,是一種淋巴細胞性肺泡炎。常發生於肺癌、乳腺癌、食管癌、惡性胸膜間皮瘤患者放療後。放射性肺炎的發生主要是因為放射性損傷,從生物學角度分析,導致放射性肺炎的主要靶細胞有兩種:毛細血管內皮細胞和肺泡 II 型上皮細胞。細胞的損傷與照射劑量呈正比。隨照射劑量的增加,內皮細胞發生腫脹變性壞死,肺毛細血管通透性升高,引起肺間質炎細胞浸潤和滲出,肺泡Ⅱ型上皮細胞的損傷,破壞了細胞表面的穩定,引起肺泡的塌陷,以致缺氧,呼吸困難。經臨床觀察表明,照射劑量<1500cgy 時,很少發生放射性肺炎,若>6000cgy 時, 會發生不同程度的放射性肺炎 臨床表現放射性肺炎多發生於照射後 1~7 個月,照射後 2~3 個月為發生高峰時間,平均發病時間 90 天,臨床病狀輕重不一,主要表現為突發性咳嗽,咳少量泡沫樣痰.
部分病人可有發熱,胸痛,呼吸困難,吐膿性痰液,憋氣,重症者可並發急性,呼吸窘迫綜合症或急性肺心病。如合併感染,則病情急劇惡化,發生呼吸衰竭而死亡。 影像學檢查X 線檢查
典型表現為與放射野相一致的條片狀實變陰影,不受肺葉限制,密度大於普通感染病灶,邊緣整齊,呈「刀切征」,病灶內支氣管以擴張為主,鄰近胸膜及縱隔器官有牽拉改變。乳腺癌術後照射引起的放射性肺炎多在第 1 至第 2 肋間;肺癌放療後的放射性肺炎多位於原發灶所在的肺葉。
CT 檢查磨玻璃型(Ⅰ型)多見於放療結束後 4~4.5 周,在放射野內出現片狀、均勻的雲霧狀模糊影,與周圍正常肺組織界線較清楚,其內可見點狀空泡影,周圍胸膜無明顯改變,如下圖 1 所示。




含氣不全型(Ⅲ型)多見於放療後 11 周至 8 年。在放射野內見超越肺段、肺葉分布的長條塊狀、不典型的三角形影,邊緣整齊,其內見支氣管充氣征、血管支氣管束及小葉間隔增厚,周圍有長條索影以及胸膜牽拉移位,條索影進展後可導致肺容積縮小,如下圖 3 所示。




圖 4 放射性肺炎(濃密纖維化型) 肺功能檢查肺功能改變表現為以下幾個方面 :一是肺活量和肺容量的降低,小氣道阻力增加,肺的順應性降低;二是彌散功能障礙,換氣功能降低。
但在肺癌病人表現較為複雜,由於肺部腫瘤放療後縮小,對肺組織及氣道的壓迫減輕,部分病人會表現為肺活量的增加及通氣功能的改善,但是由於肺泡換氣功能受損,彌散功能多表現為明顯下降,且隨著放療後時間的延長而表現得更為明顯,直到半年到 1 年後才逐漸達到穩定。 實驗室檢查放射性肺損傷實驗室檢查沒有特異性指標。
血常規如果沒有伴發肺部細菌感染白細胞並不升高,中性粒細胞分類也沒有增高,嚴重放射性肺炎病人可以出現血氧分壓下降等表現。 治療措施放射性肺炎的帶有很大的經驗性,令人滿意的治療措施仍是當前研究的熱點。以下藥物具有減輕放射性肺損傷的作用,已在臨床研究或動物實驗或得到證實。
糖皮質激素:治療放射性肺炎常用而有效的藥物,特別在早期使用更為有效,它能減輕肺實質細胞和微血管的損害程度、減輕肺組織滲出和水腫,進而有效地減輕癥狀。但激素治療對放射性肺纖維化效果差,因為激素治療的機制是抗炎和免疫抑製,可減少滲出、減少促纖維化因子產生,無法改善已經形成的纖維化病變。>> 糖皮質激素的分類短效(8~12 小時):氫化可的松(皮質醇,人體每日分泌 15~25 mg)、可的松
中效(12~36 小時):強的松(潑尼松)、強的松龍(潑尼松)、甲強龍(甲基潑尼松龍)
長效(36~54小時):地塞米松、倍他米松>> 如何用藥?小劑量治療效果不佳,可致病程延長。放射治療後,脾細胞糖皮質激素受體表達下調,因此需要足量激素。一般來說,咳嗽、氣促癥狀 2 周,結合胸部放療史和影像學改變,是給予激素治療最好的時機。急性期 RP:強的松 30~60 mg/d 或地塞米松 16~20 mg/d,可在 24~48 小時內迅速緩解癥狀體征,改善後逐漸減量 10~15 mg/d,總療程 3~8 周左右。對激素治療敏感的患者,可採用短程(2 周)甲強龍 20~40 mg 衝擊治療,及時有效的改善肺滲出。此外,有研究顯示採用霧化吸入方式,創傷小、肺部繼發感染率和睡眠障礙率更低。>> 何時撤葯?一般癥狀體徵得到控制後就應該停葯了,而何時停葯是個頭疼的問題,過快停葯可使癥狀體征出現「反跳現象」,有些醫生因為擔心反跳而撤葯過於緩慢,進而患者病程又延長,感染風險增高。初始劑量,強的松 20~66.7 mg/d,維持( 2 周左右)到緩解後減量停葯。激素減量可遵循「先快後慢」的原則:如強的松衝擊治療可直接減至 1 mg/(kg·d);初始劑量為 60 mg/d,可直接減至 40 mg/d,然後 1~2 周減少原劑量的 10% 或 5 mg,當劑量小於 7.5 mg/d 後方可停葯。還有研究者推薦了「緩快緩」的撤藥方法:甲強龍先撤 1/3,2 天后撤剩餘的 1/2,3~5 天后再全撤,在有限的樣本量(6 例)裡均獲得了很好的療效,無反跳,臨床上可以嘗試。激素減量速度沒有規律性,徐慧敏等(2013)報告激素使用中位時間為 33 天,調整中位時間 6 天,因此推薦激素使用總時間 4~6 周。細胞毒性藥物:目前使用較多的有環磷醯胺、氨甲喋呤、6-巰基嘌呤等。以環磷醯胺為例,可以 100~150 mg/d 口服,或 400 mg 靜脈注射一周 1 次或 200 mg 靜脈一周 2 次的方案。
氟伐他汀:可抑製 TGF-β的表達,進而抑製肺成纖維細胞的增生和過量基質產生。還原型谷胱甘肽:一方面能夠與體內自由基結合,加速自由基排泄,另一方面可以中和氧自由基,避免產生過氧化脂質,防止細胞的損傷。並促進正常細胞蛋白質的合成,起到保護正常細胞的作用。己酮可可鹼:一種磷酸二酯酶抑製劑,可通過提高細胞內環—磷酸腺苷在轉錄和轉錄後的水準發揮對 TNF-α等細胞因子的抑製作用。甲苯吡啶酮:新型口服有效抗纖維化藥物,實驗證明,此葯可使小鼠體內超氧化物歧化酶(SOD)活性明顯下降,並經病例證實,其對肺纖維化有明顯的抑製作用。基因與生物防治:一般僅限於動物實驗,其安全性和有效性在臨床上還有待於進一步證實。預防比治療更重要RP 病因不明,治療效果有限,預防為主。
臨床相關高危因素如:肺受照射體積大、劑量高、女性、KPS 評分低、治療前肺功能差、不吸煙、放療前行化療(應用博來黴素、吉西他濱等)、老年人和兒童。首選激素治療,輔以對症治療,包括吸氧、祛痰和支氣管擴張劑,保持呼吸道通暢,用氨磷汀放療時保護肺。
雖然 RP 是非感染性的,但是常伴有肺部感染,因此抗生素預防、治療感染也是必要的。沒有感染時抗生素僅僅是預防用藥,合併感染時應依葯敏結果選擇抗生素。放射性肺炎是胸部惡性腫瘤放療的主要併發症和死亡原因之一。目前治療效果不滿意,故放療前須精心設計照射野和劑量比,盡量減少對正常肺組織的照射範圍。重視危險因素,對患者進行個體化處理,才能將放射性肺炎的發生率降至最低。
各種糖皮質激素的劑量如何等量換算?在腫瘤時間對話框回復口令「GC」即可獲取簡易換算公式。推薦閱讀掌握這 7 招,輕鬆應對化療後血小板下降 !
惡性腸梗阻內科處理要點,看這篇就夠了!
一文讀懂 | 實體腫瘤臨床療效評價指標( RECIST1.1 )
本文首發:腫瘤時間
投稿及轉載:[email protected]
圖文:作者提供 | 題圖:站酷海洛 Plus


參考文獻: