肺癌已成為世界範圍內位居前列的健康殺手!由於大部分患者確診時即為進展期,因此只能進行系統治療,及目前相對推崇的靶向治療、免疫治療。2018年美國病理學會(College of American Pathologist,CAP)、國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)、美國分子病理學會(Association for Molecular Pathology,AMP)明確指出,EGFR、ALK、ROS1是進展期肺腺癌中的「必檢」(must-test)標誌物;同時提出可擴展至至少包括BRAF、MET、RET、ERBB2、KARS。免疫組化檢測PD-1/PD-L1也是指導進展期NSCLC患者免疫治療的一個主要預測指標。
相關指標層出不窮,檢測方案也各有優缺點;隨著臨床技術的進展,病理科標本更多為微創所得的小標本,此時如何合理的選擇和安排免疫組化指標、併兼顧分子檢測所需,則成了病理醫師不可推卸的責任。哈佛大學醫學院附屬布列根和婦女醫院(Brigham and Women』s Hospotal)病理專家Huang等人在《Advances in Anatomic Pathology》雜誌專門就NSCLC的診斷及預測性免疫組化指標進行了介紹,並強調了與分子的相關聯繫。我們將該文要點編譯介紹給大家,希望能對日常工作有一定幫助。
用於診斷的肺癌免疫組化及分子檢測指標
首先,病理醫師必須結合患者情況及臨床需求來確定是否必須進行免疫組化檢測,並謹慎、小心的選擇必要的免疫組化指標。比如某些患者已明確有進展期NSCLC病史,活檢僅為證實複發、並評估靶向治療情況(如EGFR突變型肺腺癌酪氨酸激酶抑製劑治療後是否有EGFR T790M突變、或是否有小細胞轉化),這種情況下選擇診斷性免疫組化指標可能就沒什麼必要了;更多的保留組織用於分子檢測可能更為明智。
具體診斷性免疫組化指標的選擇、抗體選擇及結果判讀、診斷意義等,本文重點介紹兩種可能認識尚有不足的疾病及相關抗體:伴睾丸核蛋白(nuclear protein in testis,NUT)基因重排的中線癌、SMARCA4缺失胸部腫瘤。
1. NUT
NUT中線癌是一種侵襲性的鱗狀細胞癌,其定義就是指存在NUT基因的重排,大部分病例為NUT和BRD4的融合,少見情況下可與BRD3、NSD3等融合。NUT中線癌最初報導於頭頸部中線部位、縱膈,主要見於年輕人;但隨著病例報導的增多,其他部位和不同年齡均可出現。該腫瘤具有高度侵襲性,生存時間中位數可能不足5-7個月。相關抑製劑的研究正在進行中。
2015年世界衛生組織胸部腫瘤分類中已經納入了NUT中線癌。從臨床角度來說,發生於年輕、非吸煙患者的「低分化鱗狀細胞癌」應考慮到該腫瘤可能。組織學表現為單型性、較原始的基底樣、上皮樣細胞至卵圓形細胞,細胞核空泡狀,可見顯著程度不等的核仁。突然角化可作為有用的診斷線索,但僅少數病例存在這一現象。診斷中還需注意鑒別其他的癌、惡性黑色素瘤、小圓細胞肉瘤等。
NUT中線癌的免疫組化可不同程度表達CK、p63、p40、TTF-1、CD34、CD99;這更使得診斷複雜化。因此結合臨床、形態學表現,必要時應進行NUT免疫組化檢測。據報導針對NUT的抗體(Cell Signaling Technology公司產品克隆號C52B1)相比FISH檢測來說,其敏感性可達87%,特異性100%。免疫組化檢測NUT時,陽性定位於細胞核,為特徵性的斑片狀著色。結果判讀中陽性是指50%以上的腫瘤細胞出現細胞核著色。組織學表現與其類似的腫瘤(如生殖細胞腫瘤)也可出現局灶弱陽性(60%以上的無性細胞瘤可有此結果)。對於多個方面強烈提示NUT中線癌、但免疫組化結果陰性或不確定的病例,可通過FISH檢測NUT重排。
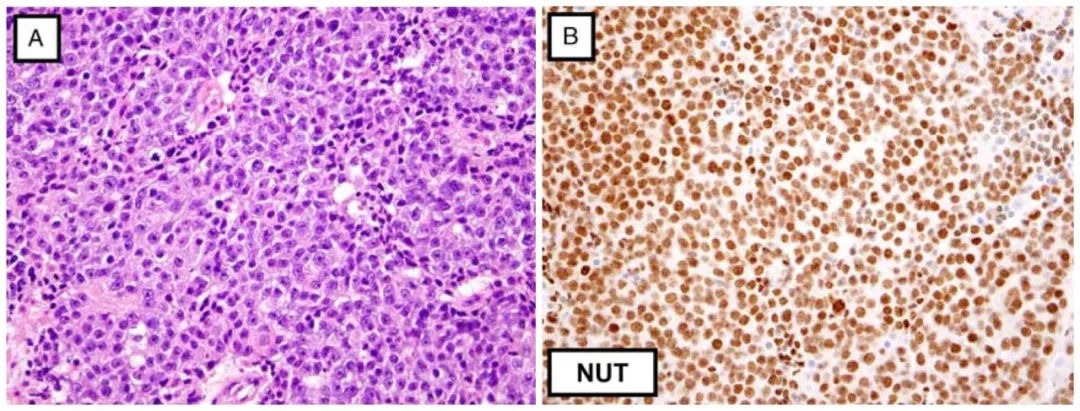
圖1. NUT中線癌,表現為特徵性的實性及小梁狀結構,細胞形態為低分化的原始細胞至基底樣細胞;免疫組化NUT為細胞核瀰漫斑片狀表達。
2. SMARCA4
約6%的肺腺癌具有SMARCA4突變,而肺鱗癌中罕見。其實該突變可見於多種腫瘤,如95%以上的高鈣血症型卵巢小細胞癌、以及部分橫紋肌腫瘤、SMARCB1表達的上皮樣肉瘤、未分化至低分化的子宮內膜癌、胃腸道腫瘤、尿路上皮腫瘤、鼻腔鼻竇腫瘤等都有SMARCA4的種系性或體細胞性突變。子宮內膜癌中,SMARCA4失表達似乎與組織學去分化有關。
SMARCA4缺失型胸部腫瘤是最近才提出的,包括SMARCA4缺失型肺部肉瘤和SMARCA4缺失型肺腺癌。最初的報導來自19例縱膈較大、侵襲性腫物。SMARCA4缺失型肺部肉瘤主要見於吸煙的男性,年齡分布較廣,但中位數為30-40歲。腫瘤也可表現為肺部原發小腫物(<1.5cm)、或見於從不吸煙者。其分子生物學特徵為SMARCA4失活突變。組織學表現為黏附性差的圓形至卵圓形細胞,胞質豐富、嗜酸性,常出現橫紋肌樣形態。這些形態學特點與SMARCB1缺失型腫瘤有一定重疊。同時,伴橫紋肌樣形態的肺部腫瘤似乎多見SMARCA4缺失,有研究表明高達30%的病例有此異常。需注意鑒別診斷低分化癌、惡性黑色素瘤、肉瘤、生殖細胞腫瘤。
免疫組化方面,SMARCA4缺失型肺部肉瘤通過克隆號為EPNCIR111A或克隆號為ERP3912的抗體進行檢測時,表現為SMARCA4的完全缺失。同時該腫瘤還會有SOX2的過表達、SMARCA2的表達缺失;CK、CD34、SALL4表達結果不一,但不表達NUT、S-100、claudin-4。

圖2. SMARCA4缺失型肺部肉瘤,形態學特點為原始的上皮樣細胞至圓形細胞,可見顯著程度不等的核仁;免疫組化SMARCA4/BRG1表達完全缺失。SMARCA4缺失型肺部肉瘤具有高度侵襲性,生存時間中位數4-7個月,但文獻中也有生存高達9年的病例報導。
NSCLC中約2%的病例具有SMARCA4的缺失。與前述SMARCA4缺失型肺部肉瘤相反,SMARCA4缺失型肺腺癌可出現分化型組織學特點,如明確的腺樣結構形成;可表達CK7和HepPar-1,但一般不表達TTF-1。Claudin-4可作為SMARCA4缺失型肺部肉瘤和癌的鑒別診斷指標,但去分化肺腺癌中該指標有時也會表達缺失。
明確診斷為SMARCA4缺失型胸部腫瘤除前述預後意義外,還可用於指導臨床:SMARCA4缺失的NSCLC意味著對鉑類為主的化療方案敏感。文章來源於公眾號:ai幫幫