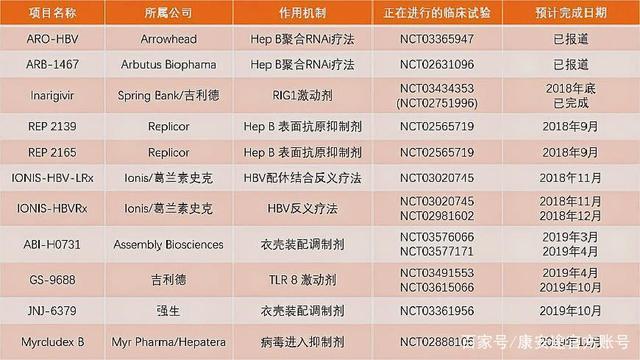
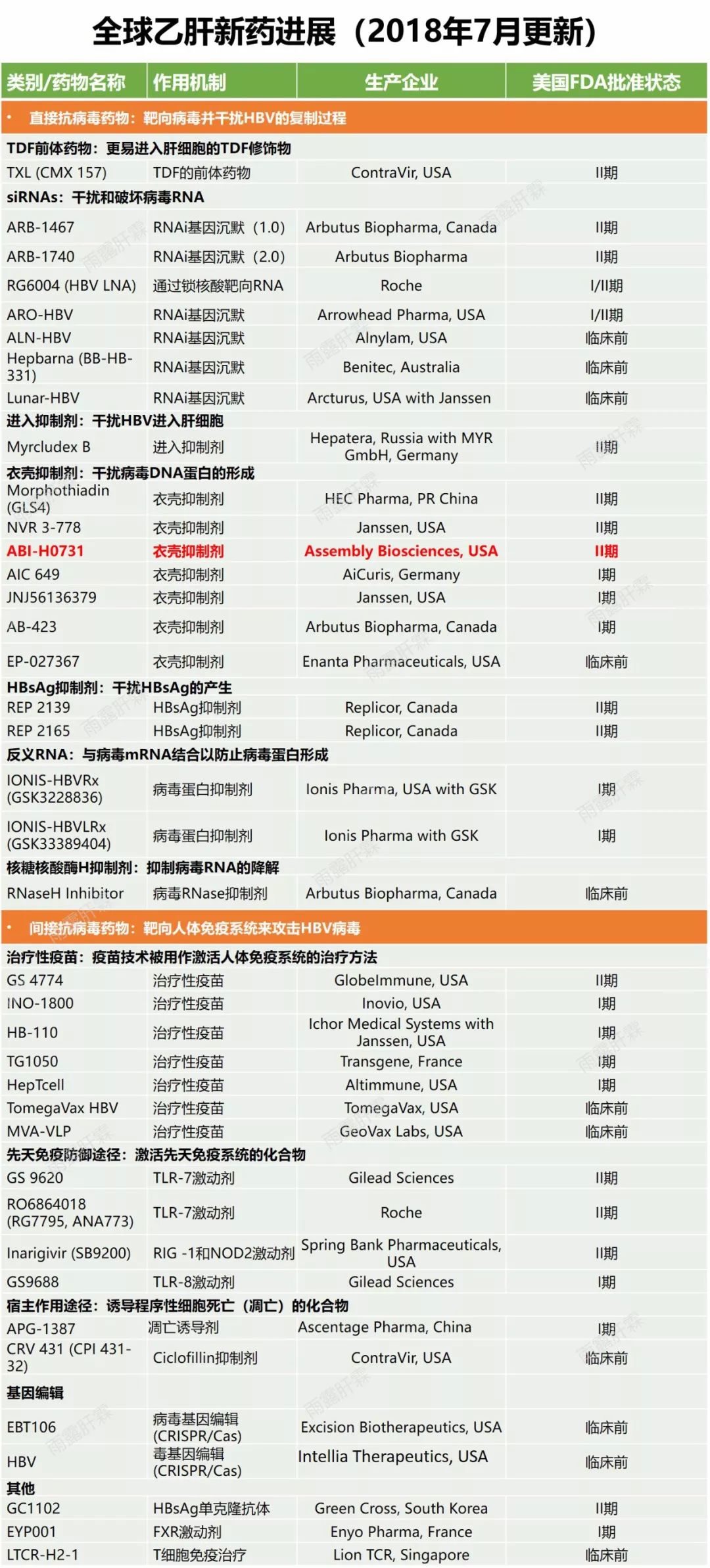
Assembly Biosciences公司旗下B肝在研新藥ABI-H0731,2020年8月17日更新人體臨床試驗II期試驗進展。本試驗II期臨床編號:NCT04454567(見下圖),一項IIa期、多中心、單盲、安慰劑對照研究,評估ABI-H0731對慢性B肝對核苷逆轉錄酶抑製劑的強化治療,研究預計2020年8月5日開始。

B肝在研新藥0731,2期a部分啟動,預計2023年8月完成
本試驗登記在全球臨床試驗數據庫中,主要探討ABI-H0731在部分病毒學得到抑製的參與者中,加入核苷逆轉錄酶抑製劑時的安全性和抗病毒活性。根據本試驗介紹,招募40名符合條件的受試者,IIa期預計將於2023年8月7日完成。小番健康將介紹ABI-H0731的IIa期試驗設計,HBV感染者且僅對核苷逆轉錄酶抑製劑進行部分病毒學抑製的參與者,接受每日口服1次300毫克劑量ABI-H0731,外加核苷逆轉錄酶抑製劑,連續96周,隨後再單獨接受核苷逆轉錄酶抑製劑治療24周(總共120周)。
核苷逆轉錄酶抑製劑(Nrtl),簡單來講,即包括恩替卡韋(ETV)、富馬酸替諾福韋艾拉酚胺(TAF)或富馬酸替諾福韋二吡呋酯(TDF)。安慰劑對照組:安慰劑+核苷逆轉錄酶抑製劑(Nrtl),HBV感染者對Nrtl部分病毒學抑製的參與者,將接受ABI-H0731安慰劑治療,每日1次,加上48周標準護理(SOC)NrtI,隨後口服300毫克ABI-H0731,每日1次,外加SOC-NrtI,持續48至96周,然後單獨服用SOC-NrtI治療96周至120周。

Assembly Biosciences公司後續將根據IIa期試驗完成後,關注如下主要結果指標:最多120周,出現不良事件的參與者人數;96周之前,過早停止治療的參與者人數;最多120周,實驗室異常的參與者人數;第48周治療時,HBV-DNA小於Lower-Limit of Quantification(LLOQ)的參與者人數。關注次要結果指標如下:
基線和在120周之前預先指定的時間點,log10 HBV-DNA與基線相比的平均變化;預先指定的時間點到120周時,HBV DNA<LLOQ的參與者人數;預先指定的時間點到120周時,HBV DNA小於檢測限(LOD)的參與者人數;基線和在120周之前預先指定的時間點,log10乙型肝炎病毒前基因組RNA(pgRNA)與基線相比的平均變化;預先指定的時間點到120周時,HBV-pgRNA<LLOQ的參與者人數;

基線檢查時和120周之前的指定時間點,log10血清B肝e抗原(HBeAg)與基線檢查相比的平均變化;基線檢查時和120周之前預先指定的時間點,log10血清B肝核心相關抗原(HBcrAg)與基線檢查相比的平均變化;基線和在120周之前預先指定的時間點,log10血清乙型肝炎表面抗原(HBsAg)與基線相比的平均變化;基線和120周之前預先指定的時間點,丙氨酸轉氨酶(ALT)正常化的參與者人數;
給藥前和給藥後預先指定的時間點,直至第100周,ABI-H0731的血漿濃度;給藥前和給藥後至第100周的預先指定時間點,恩替卡韋的血漿濃度;預先指定的時間點到120周,有治療無反應的參與者中B肝病毒變異的發生率。研究人員在結果關注指標中,已將病毒前基因組RNA(pgRNA)、HBV-pgRNA、B肝核心抗原等新檢測技術納入其中,這也是目前慢性B肝檢驗技術有所提升表現。

小番健康結語:ABI-H0731目前已在國外進展到臨床試驗2期,在國內Assembly Biosciences公司;艾衫貝瑞生物科技(上海)有限公司,已提交IND申請,在國家藥監局審評審批中(在藥審中心)一欄可關注到藥品名稱為ABI-H0731片,適應症:慢性乙型肝炎,臨床試驗默示許可中。因此,該藥目前在國內還未啟動臨床試驗,處於IND申請當中。(以上主要介紹試驗設計內容和進展,未介紹藥物作用原理機制)返回搜狐,查看更多
責任編輯: