本文來源:時代周報 作者:杜蘇敏
近日,“抗癌藥一針120萬可清零癌細胞”衝上微博熱搜,CAR-T藥物阿基侖賽注射液(商品名為奕凱達)進入公眾視野。
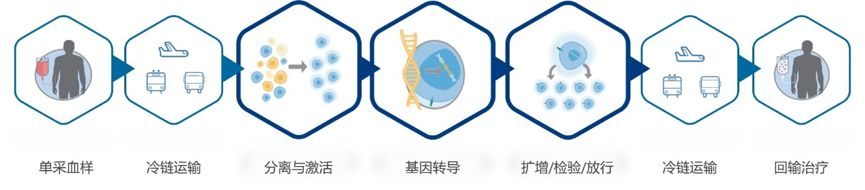
阿基侖賽注射液是個體化定製活細胞藥品,通過基因工程修飾患者自體T細胞,表達靶向腫瘤抗原分子,激活T細胞介導殺傷腫瘤細胞。2021年6月,複星凱特生物科技有限公司(下稱“複星凱特”)研製的阿基侖賽注射液藥物獲上市批件。
售價120萬元,皆因這是一款“私人定製”藥品。
9月14日,時代周報記者以患者親屬的名義聯繫阿基侖賽注射液經銷商武漢百濟新特藥房有限公司(下稱“百濟新特藥房”)。“產品售價120萬元,不包括其他治療費用,就是產品費用。”該工作人員多次向時代周報記者強調,該產品沒有現貨,建議患者先到醫院谘詢醫生,確定可以使用後再來定製。
因價格高昂且為私人定製,該藥品無法退換。“訂的時候就要付全款,不能退換。”上述工作人員說。
時代周報記者注意到,網上流傳出的一張複星凱特藥品銷售訂單上顯示,本訂單生效後,甲方(複星凱特)即啟動藥品生產製備。訂單生效五個工作日內,購買方需向甲方支付本銷售訂單所列的含稅供貨價款。
就阿基侖賽注射液商業化和CAR-T產品研發等問題,時代周報記者分別聯繫複星凱特和複星醫藥(600196.SH)並發送採訪函,截至發稿,未獲回復。
複星凱特對外回應稱,CAR-T產品定價將根據價值、療效、成本等各項因素綜合考量制定,目前定價方案尚未最終確定,正在多方溝通,希望惠及更多患者。
儘管價格昂貴,但CAR-T細胞療法市場的前景卻不容小覷。藥明巨諾(02126.HK)在招股說明書披露,未來中國的CAR-T療法市場規模將由於患病人數上升、患者負擔能力的提高以及監管政策的利好等原因持續擴張,預計2024年中國CAR-T療法市場規模將達到54億元,2030年將達243億元。
目前,中國已批準兩款CAR-T產品上市,除了複星凱特的阿基侖賽注射液外,另一款是由藥明巨諾生產的瑞基奧侖賽注射液(商品名為倍諾達),但目前尚未公布定價。這兩家企業均引進國際已上市的CAR-T產品技術,另外還有7款國產CAR-T進入二期臨床試驗。
療效顯著價格貴
CAR-T(Chimeric Antigen Receptor T,嵌合抗原受體T細胞)細胞療法,指的是從患者血液中提取T細胞,並在實驗室中將它們改造為CAR-T細胞,使得這些T細胞能夠識別並殺死腫瘤細胞。之後,醫生會將這些CAR-T細胞通過靜脈點滴的方式重新輸回患者體內。
T細胞是一種小淋巴細胞,能發生特異性免疫應答,表面較為光滑,起源於骨髓中的多能幹細胞,在胸腺的影響下,由淋巴幹細胞發育成熟為T細胞,並定位於周圍免疫器官的胸腺依賴區。T細胞壽命較長,可達數月至數年。多數T細胞不斷在周圍免疫器官中循環,遷移。在血液中佔淋巴細胞的70%-80%,淋巴結中佔75%,脾髒中佔35%-50%,主要完成細胞免疫功能。
2013年,《Science》雜誌將CAR-T細胞療法評為全球十大科技突破之首。目前,除了在治療部分白血病和淋巴瘤中獲得明顯成效以外,科學家們還在其它血液癌症和一些實體腫瘤癌症中測試CAR-T細胞療法。
複星凱特官網稱,阿基侖賽注射液是複星凱特引進美國Kite Pharma(吉利德旗下公司,下稱“Kite公司”)全球首個獲批治療非霍奇金淋巴瘤的CAR-T產品Yescarta(Axi-Cel)後,進行技術轉移並獲授權在中國進行本地化生產的靶向人CD19自體CAR-T細胞治療產品。
根據ZUMA-5單臂、開放標簽、多中心試驗結果,中位隨訪時間達到17.5個月時,療效可評估的104例惰性非霍奇金淋巴瘤患者的總緩解率達到92%,完全緩解率達到76%。
複星凱特是複星醫藥與Kite公司的合營企業。2017年1月,複星醫藥發布公告稱,通過其全資子公司上海複星醫藥產業發展有限公司投資不超過等值8000萬美元,與Kite公司共同設立中外合作經營企業複星醫藥凱特生物科技(中國)有限公司(暫定名),以在內地、香港及澳門特別行政區開拓癌症T細胞免疫療法市場。
同年4月,複星凱特在上海注冊成立。此後,複星凱特從Kite公司引進Yescarta,獲得全部技術授權,以及擁有其在中國包括香港、澳門的商業化權利。

今年6月23日,國家藥監局官網公示,批準阿基侖賽注射液上市,用於治療既往接受二線或以上系統性治療後複發或難治性大B細胞淋巴瘤成人患者(包括彌漫性大B細胞淋巴瘤非特指型、原發縱膈大B細胞淋巴瘤、高級別B細胞淋巴瘤和濾泡淋巴瘤轉化的彌漫性大B細胞淋巴瘤)。阿基侖賽注射液也是我國首個批準上市的CAR-T細胞治療類產品。
國家藥監局當時還指出,該品種的上市為既往接受二線或以上系統性治療後複發或難治性大B細胞淋巴瘤成人患者提供了新的治療選擇。
據媒體報導,上海陳女士在2019年6月確診彌漫性B大細胞瘤,經過治療後又複發,後採用阿基侖賽注射液治療,8月2日,醫院將培養好的一袋CAR-T細胞,輸入到陳女士體內。8月26日,陳女士在PET-CT檢查下,發現體內暫時沒有癌細胞,症狀完全得到緩解。
目前來看,儘管治療優勢顯著,但阿基侖賽注射液120萬元/袋的價格仍然讓多數普通人望而卻步。據頭豹研究院《2021年中國腫瘤治療行業概覽》報告顯示,腫瘤患者採用傳統手術治療的費用為1萬-5萬元/次,放療費用為1萬-3萬元/次,化療費用為1.8萬-12.7萬元/年。此外,靶向治療與免疫治療的花費更為昂貴,分別為14.6萬-43.8萬元/年,及18.3萬-54.8萬元/年。
相比之下,阿基侖賽注射液價格確實不菲,這也引發了外界對其定價合理性的質疑。國外上市的同類產品的定價或在一定程度上作為參考。以Yescarta為例,該款產品在美國的上市價格同樣貴得讓人倒吸一口氣,為37.3萬美元(折合人民幣約240萬元)。此外,由諾華研發的全球首款上市CAR-T療法Kymriah,其白血病適應症費用為47.5萬美元(折合人民幣約306萬元),淋巴瘤適應症費用為37.3萬美元(折合人民幣約240萬元)。
CAR-T產品定價高昂的原因,一方面是因為產品本身的研發投入就很大。據複星醫藥發布的公告,截至2021年7月,複星凱特現階段針對該產品累計研發投入約人民幣7.04億元(含專利及技術許可費用,未經審計)。
個性定製、複雜的生物工程進程提高了CAR-T產品的生產成本。藥明巨諾高級副總裁、首席商務官吳瓊就曾指出,CAR-T藥品的生產和使用過程複雜,不僅要均一穩定地生產同質化的高質量產品,在製造和交付上要求精準和速度,還要對每批次產品進行嚴格的質量檢測。另外,CAR-T的質量控制涉及存儲、生產、使用等多個環節。
CAR-T賽道擁擠
谘詢公司弗若斯特沙利文預計,全球CAR-T細胞療法市場將從2019年7億美元增至2024年66億美元,2030年將達218億美元。癌症患者群的攀升、具備使用資格醫院的增多及利好政策和資本投資驅動,中國市場規模預計在2030年增至289億元,複合年增長率達45%。
市場廣闊,研究熱情高漲。據ClinicalTrials.gov數據,中國目前已有475項關於CAR-T的研究,遠超美國279項。另據Insight數據庫顯示,截至目前,中國已有358個正在進行的CAR-T臨床試驗,臨床居前的包括藥名巨諾、傳奇生物、科濟藥業(02171.HK)等。
其中,藥明巨諾系CRO巨頭藥明康德和巨諾醫療於2016年4月在上海成立的合資公司,擁有專注為血液及實體瘤開發、製造和商業化的突破性細胞療法的一體化平台。2020年11月,藥明巨諾在港交所掛牌。
今年9月3日,國家藥監局官網公示,藥明巨諾靶向CD19的CAR-T產品瑞基奧侖賽注射液(商品名為倍諾達)已正式獲批,用於治療經過二線或以上系統性治療後成人患者的複發或難治性大B細胞淋巴瘤。
藥明巨諾擁有多款CAR-T細胞療法產品,絕大多數還處於臨床前階段,瑞基奧侖賽注射液是公司首款獲批上市的創新產品,同時也是國內繼阿基侖賽注射液之後第二款獲批CAR-T產品。
此外,金斯瑞旗下子公司傳奇生物擁有7款處於臨床階段的CAR-T細胞療法產品,科濟藥業擁有5款處於臨床階段的CAR-T細胞療法產品。

廣闊的市場前景引來眾多企業入局,但潛在問題仍存。有研報就指出,目前國內企業針對CAR-T療法布局的靶點同質化嚴重,主要聚焦在CD19、BCMA上,涉及少量其他新興靶點。
競爭激烈,“價格戰”是否在未來一觸即發。近日,藥明巨諾董事長李怡平在接受媒體採訪時就坦言,“我覺得價格戰的可能性是永遠存在。咱們中國人做生意的時候,很多時候就喜歡打價格戰。其他人挑起價格戰,我們可能要被迫應對。”
即便沒有價格戰,百萬元售價也讓產品商業化前景打上問號。
7月30日,國家醫保局官網發布的《關於公示2021年國家醫保藥品目錄調整通過初步形式審查藥品及信息的公告》包括阿基侖賽注射液,這一舉動難免讓外界對天價抗癌藥納入醫保產生預期。
獨立財經評論員周正國在接受時代周報記者採訪時表示,進入醫保目錄,相當於國家稅收和國民統籌保險一起補貼治病成本,需要考慮負擔程度;再者也需考慮覆蓋範圍,加大科研力度,世界市場份額等。
而在李怡平看來,現在談納入醫保為時尚早,“商業保險是很願意把我們的產品納入到報銷體系中的,現在已經有好幾家商業保險計劃將我們納入其中。”
9月14日,複星醫藥在回答投資者提問時表示,在把控藥品質量、保障製造和交付的精準性和速度的同時,合營公司複星凱特也正積極通過擴展適應症、持續優化成本、探索商業保險等多元化的支付手段等,增加該產品可及性以惠及更多患者。