胰腺癌(pancreatic cancer,PDAC)是致死率最高的惡性腫瘤之一,五年生存率不足9%。胰腺癌預後較差的原因有很多,其中非常重要的一點是胰腺癌在早期易發生轉移,只有約20%的患者在發生轉移前確診並獲得手術的機會。因此,探究胰腺癌發生轉移的機制、尋找新的治療靶點具有重要的臨床價值。然而,目前胰腺癌高轉移性能細胞系工具較為缺乏,一定程度上限制了我們探究腫瘤發生轉移的分子水準機制。
2019年3月13日,《中國科學:生命科學》英文版Science China Life Sciencs在線發表了北京協和醫院趙玉沛院士課題組題為「Integrated analysis of gene expression and methylation profiles ofnovel pancreatic cancer cell lines with highly metastatic activity」的研究。
該研究通過人工基底膜篩選構建出了兩株高侵襲性胰腺癌細胞株mia paca-2 In8和panc-1 In8,並通過體外實驗與親本株進行了對比。研究結果顯示,高侵襲性細胞株形狀更加狹長尖銳,細胞間黏附更弱,更接近間質細胞表型,體外Transwell實驗和劃痕實驗也證實高侵襲細胞株的侵襲和遷移能力明顯增強。接下來,課題組建立了胰腺癌小鼠尾靜脈移植瘤模型,並用IVIS系統實時監測轉移灶的形成。結果顯示與親本株相比,高侵襲性細胞株更易在小鼠體內種植形成轉移灶。
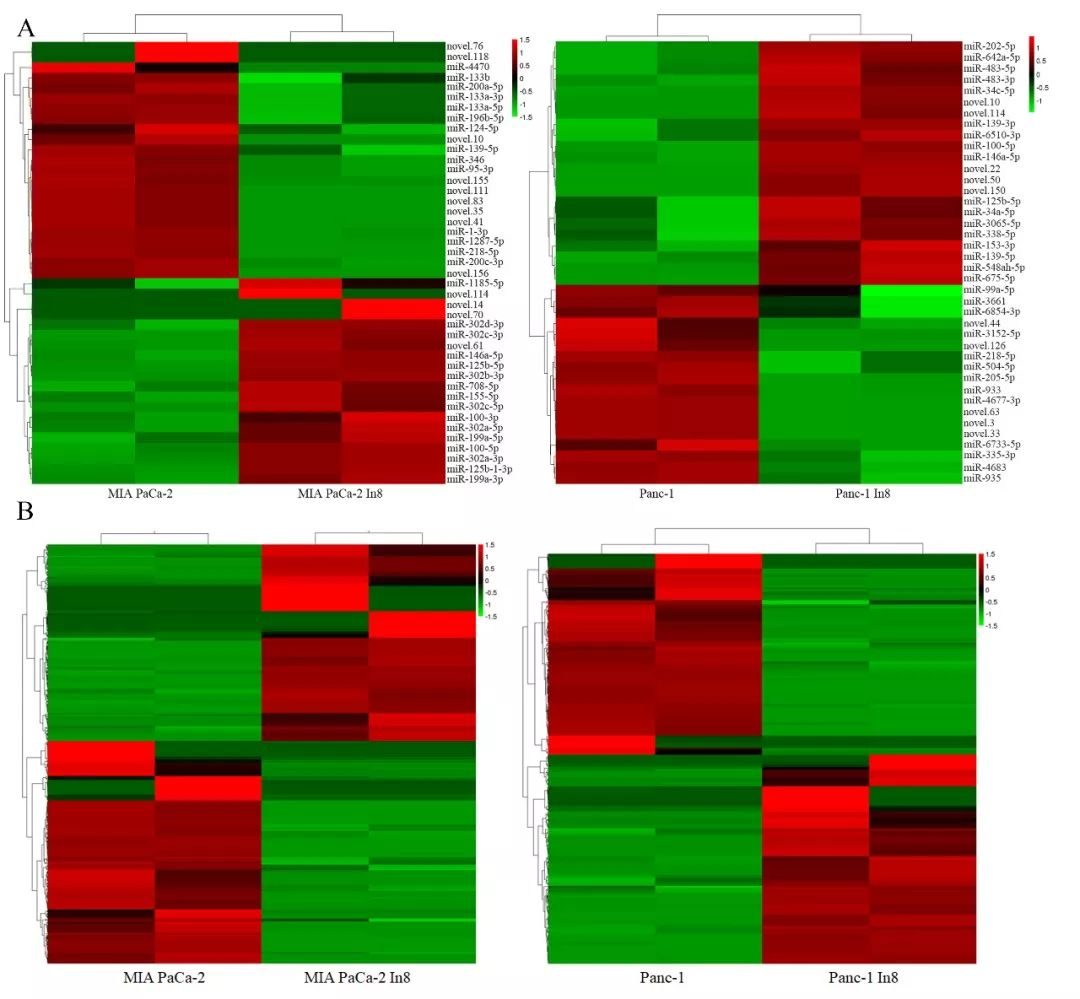

該研究還從mRNA,miRNA,lncRNA以及DNA甲基化水準等多組學水準,將高侵襲性細胞株與親本株進行對比,篩選出了一批差異表達和差異甲基化修飾的基因,並進行了ceRNA網路分析,為今後更深一步進行胰腺癌轉移相關的分子機制研究提供基礎。


值得一提的是,儘管之前有過關於高侵襲性胰腺癌細胞株的報導,但極少有研究者通過誘導方法,篩選構建高侵襲性細胞株。該文所使用的人工基質膜包含層粘連蛋白,TGFβ,膠原蛋白,FGF的生長因子,可以在體外模擬細胞外基質,通過多輪篩選後,獲得更強侵襲遷移能力的細胞株。與既往研究使用原位誘導或小鼠尾靜脈注射腫瘤細胞誘導的方法相比,該方法更加方便快捷並且有相同的效果。
總之,該研究建立了兩株高侵襲性的胰腺癌細胞株,mia paca-2 In8和panc-1 In8,通過體內和體外實驗證實了高侵襲性細胞株和親本株表型的差異,並分析比較了親本株和高侵襲性細胞株基因表達和甲基化修飾的差異,為未來胰腺癌侵襲轉移的分子機制研究提供有效的實驗工具和參考數據。
點擊下方「閱讀原文」免費讀全文: