全球現有可以使用的慢B肝兩種療法分別是核苷(酸)類似物(NAs)和聚乙二醇干擾素α(PEG-IFN)。NA優勢是具有良好耐受性和有效抗病毒活性,PEG-IFN的優勢是有限療程、不耐藥以及持久治療後反應。

B肝探索cccDNA形成分子機制,美研究人員開發,新型生化系統
一、聚合酶抑製劑作用HBV原理
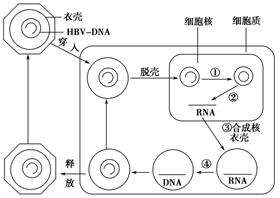
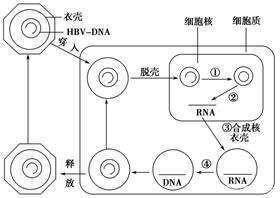
核苷類似物主要抑製的是HBV聚合酶,不直接影響cccDNA的活性。cccDNA,它在靜止的肝細胞中十分穩定,攻克其高度穩定性也是慢B肝研究熱門課題之一。一般情況下,在聚合酶抑製劑應用之後,cccDNA水準也會明顯下降,原因是細胞質中的HBVDNA合成受到了強烈地抑製,進而導致HBV的核衣殼向細胞核的再循環不足,從而從血液中傳入的病毒較少。
二、對cccDNA生物發生的機制見解
即便如此,應用這種療法(NA)來耗竭cccDNA也需要很多年時間。除此之外,如果病毒抑製不徹底,則可能出現抗病毒耐藥變體,這種現象更主要發生在第一代NAs,拉米夫定或阿德福韋。在HEP DART 2021大會上,美國普林斯頓大學劉易斯·托馬斯實驗室研究人員帶來了對乙型肝炎病毒 (HBV) cccDNA生物發生的機制見解。
研究人員介紹,B肝病毒是一種嗜肝病毒,可感染人類和黑猩猩。估計全球有20億人接觸過HBV,其中2.50-4億人為慢性感染者。每年約有 887,000 人死於與 HBV 相關的肝病。目前,慢性 HBV 感染無法治愈,患者需要終生接受抗病毒治療。
HBV慢性化的根本原因是共價閉合環狀DNA(cccDNA)的形成,它是通過修複病毒粒子傳遞到肝細胞的帶有病變的HBV松弛環狀DNA(rcDNA)而形成的。然而,目前對cccDNA形成的分子機制知之甚少。

三、新型生化系統開發意義
在大會上,劉易斯·托馬斯實驗室研究人員介紹已開發了一種新的生化系統,它可以在體外修複HBV rcDNA以形成cccDNA。研究人員使用這個生化系統,並檢查了修複rcDNA的每個單獨病變的分子機制。
之前已經確定了參與DNA滯後鏈合成的五種成分,它們在體外cccDNA中是必不可少的。研究人員現在已經確定修複rcDNA的正負鏈需要不同的因素。正鏈的修複需要所有五個因素,其修複類似於岡崎片段的成熟,而負鏈的修複只需要這五個因素中的兩個。研究人員還發現靶向這些因子的抑製劑可以在體外和/或細胞培養中抑製cccDNA的形成。
綜上所述,研究人員已經建立了一個生化系統,它可以用純化的人類蛋白質完全重建cccDNA的形成。提供了體外rcDNA修複的機制見解和阻斷cccDNA形成的潛在治療方法。

四、科學界還需深入了解cccDNA來尋找阻斷潛在療法
小番健康結語:最近兩年來,基因編輯技術應用於慢B肝新藥開發領域的潛力不斷被科學家提及,這種潛力主要指能夠直接靶向cccDNA,因此也稱其為cccDNA抑製劑。要注意一點,即便是目前全球比較前沿的相關醫藥技術也只能夠作為cccDNA抑製劑,而非cccDNA清除劑。
cccDNA在肝細胞核中高度穩定,科學界對cccDNA的形成分子機制以往知道得信息還很少,基於這一原因,本研究人員開發了這個新的生化系統,它是用來專門了解cccDNA形成的分子機制,以此來尋找阻斷cccDNA形成潛在療法。返回搜狐,查看更多
責任編輯: