導語:沒有無緣無故的善良。
這兩天關於瑞德西維於中國合作的各種爭議,我突然想起來另外還有一些考慮因素供你們參考。
做新藥開發的一個重大挑戰,就是如何在臨床測試期間找到足夠數量的,已確診的適應症患者來自願參加臨床測試。
這種患者的選擇十分講究,只能是單一病源所引發的症狀,一般選樣的樣板數量從幾十到幾百人不等,這個過程十分昂貴,也十分耗時費力,也要花費大量的精力。我們一般是請第三方公司幫我們進行,價格至少千萬以上。
測試過程中,首先需要闡述新藥種的藥理,如何用科學的方法來篩選測試對象,論證這個藥品對所針對的病症有效的理論支持(後面要有大量的病理學,倫理和測試數據的量化分析來支持);證明藥物為何及如何有效;同時還要展示和論證是否對病人有其他副作用,這種副作用對人體的害處有多大。藥品批準審核部門要對這些試驗數據進行評估,反覆提問,平衡利弊。
而申請方每次收到問題後,必須能夠給審批方提供滿意的答覆。一般要先從動物開始,通過試驗,搜集數據,在判斷可以在人身上進行初步測試後,才可以到人身上,這其中每一步都需要審批。
瑞德西維如果要作為新冠狀病毒的治療用藥,目前恐怕也只能到中國來做測試。因為武漢是這種全新病毒的原發地,中國有足夠的病人可供測試方篩選。加之目前疫情嚴峻,政府在審批方面也會提供快速的綠色通道,過程會加快許多。
所以,從這個角度看,和中方合作,瑞德西維也是不吃虧的。因為在世界其他地區,恐怕也找不到這麽多的新病毒患者,各種治療方法的組合及對比參數等等。供你們參考。
附公司內部專家對瑞德西維的點評:
“一類的新藥研發肯定要經過動物研究後獲得相關數據,證明安全性和有效性,才能考慮人體試驗。
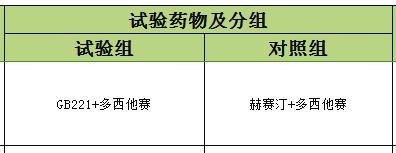
我不清楚該藥之前做過沒做過1期和2期臨床試驗,如果做過,那至少在中國3期臨床需要做200例患者,加上對照組100例,共需要300例,考慮有剔除意外,需增加20%,至少360例。
但目前正巧趕上我們新藥管法也有這方面要求,就是‘同情用藥’。既然沒有特效藥,與其病情惡化甚至死亡,那經過倫理和知情同意,管理部門批準,通過評價獲益和風險,就可以上臨床,當然不吃虧。
別的地區的確找不到這麽多病例,且這麽嚴重的公共衛生事件。關於對照藥,因以前沒有,所以臨床判定的終點會以關鍵指標和效果作為標準。”