2018年諾貝爾生理學或醫學獎於北京時間10月1日揭曉,美國免疫學家詹姆士·艾利森(James Allison)與日本科學家本庶佑(TasukuHonjo)因「發現腫瘤免疫治療負調節機制」而獲獎
作者|何勇
來源|南山呼吸
2018年諾貝爾生理學或醫學獎於北京時間10月1日揭曉,美國免疫學家詹姆士·艾利森(James Allison)與日本科學家本庶佑(TasukuHonjo)因「發現腫瘤免疫治療負調節機制」而獲獎。
其實,腫瘤免疫治療並非一時興起,近幾年一直是腫瘤研究的「寵兒」。自2011年抗CTLA-4免疫檢查點抑製劑伊匹單抗(Ipilimumab)獲黑色素瘤適應證尹始,便拉開了免疫檢查點為主的腫瘤免疫治療序幕,主要是通過抑製腫瘤細胞的免疫逃逸,調動自身免疫系統功能而消除腫瘤。
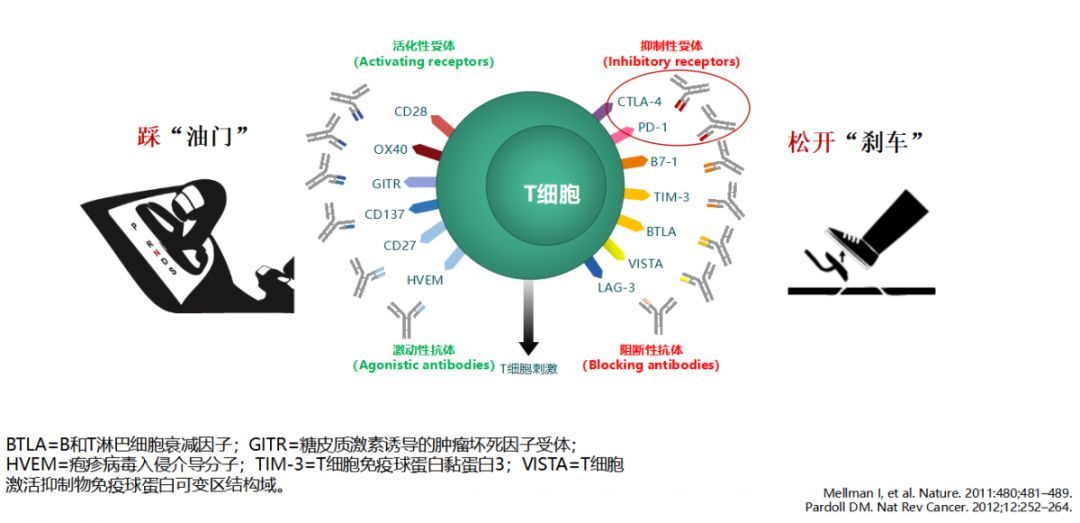

圖1ICI腫瘤免疫治療原理:增強T細胞刺激(激動性抗體vs阻斷性抗體)
數據來源:Mellman I, et al. Nature. 2011:480;481–489;Pardoll DM. Nat Rev Cancer. 2012;12:252–264.
腫瘤免疫治療的重頭戲腫瘤免疫治療歷史悠長。早在100多年前,紐約癌症醫院的外科醫生威廉· 科利(William Coley)發現可以利用高溫殺死的細菌刺激免疫系統,從而對抗惡性腫瘤。1953年Coley的成果首次公開發表,提出了腫瘤免疫的概念。
1978年腫瘤特異性單克隆抗體技術的誕生,20世紀90年代INF-α用於腫瘤的輔助治療,腫瘤免疫治療經歷了狂熱期(1978-1985)、質疑期(1985-1997)和復甦期(1997-2010),直到抗CTLA4藥物伊匹單抗(Ipilimumab)獲批用於晚期黑色素瘤治療。
2014年,兩款PD-1抗體(Nivolumab和Pembrolizumab)正式獲批,將以免疫檢查點為主的腫瘤免疫治療強勢拉入了人們的視野。




圖2抗PD-1/PD-L1單抗作用機制(MOA)
數據來源:Blank C, et al. Cancer Immunol Immunother. 2007;56:739-745;Carter LL, et al. Eur J Immunol. 2002;32:634-643. Chikuma S, et al. J Immunol. 2009;182:6682-6689.
PD-1於1992年由今年另一位諾獎得主,日籍科學家本庶佑(TasukuHonjo)發現。當時也只是報導發現了一個細胞程式性死亡相關的蛋白而已,並未引起過多的重視;直到1997年,華人科學家陳列平發現B7-H1(PD-L1)對免疫反應的負性調節作用,PD-1和PD-L1結合的信號通路才逐漸得到關注,PD1/PD-L1免疫檢查點抑製劑隨後被應用於臨床抗腫瘤研發。
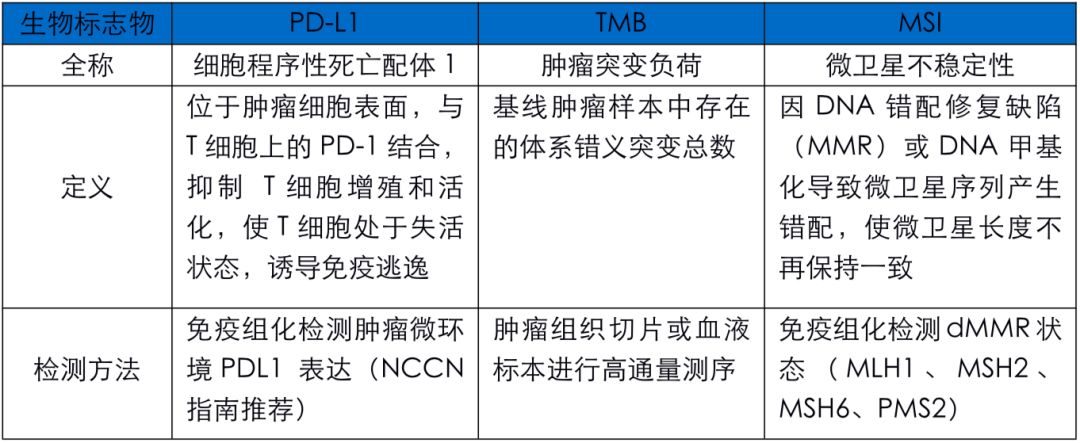
PD-1是由 PDCD1基因編碼的l型跨膜蛋白,是T細胞表面重要的抑製性受體。 PD-1的配體有 PD-L1和 PD-L2。受到 T細胞攻擊的腫瘤細胞會高表達PD-L1和 PD-L2配體,並與 T細胞上的PD-1受體結合,抑製活化T細胞的增殖。同時抑製IL-2的分泌,抑製T細胞的活化,誘導免疫逃逸。
抗PD-1/PD-L1單抗,解除活化和增殖抑製,使腫瘤特異性T細胞處於活化狀態,促進T細胞增殖。
細說免疫腫瘤的「特徵」腫瘤細胞具有持續增殖,無限複製,誘導血管生成,基因組不穩定和侵襲等特徵,而免疫逃逸也是新發現的腫瘤生物學的十大特徵之一,在腫瘤的發生和發展中發揮著關鍵作用。免疫檢查點抑製劑正是針對免疫逃逸過程發揮作用,屬於主動免疫中的非抗原依賴性的免疫治療。腫瘤免疫治療不同於傳統的化療和靶向治療,通過調動機體的免疫系統活化從而識別和殺傷腫瘤。因此,腫瘤免疫治療具有不同的療效特徵和免疫相關不良反應(irAE)。截止目前,腫瘤免疫治療最主要的特徵包括:應答持久、非常規應答和療效評估。
一應答持久
由於抗腫瘤免疫應答通過七步循環免疫周期(腫瘤細胞死亡並釋放腫瘤特異性抗原;抗原遞呈細胞攝取並處理腫瘤新抗原;抗原呈遞細胞進入淋巴結激活T細胞;激活的T細胞離開淋巴結進入循環系統;T細胞穿過血管壁浸潤到腫瘤微環境;T細胞通過特異性受體識別腫瘤細胞;腫瘤細胞被T細胞識別並殺傷),抗腫瘤免疫循環不斷重複,抗腫瘤免疫反應持續加強。同時,隨著免疫應答的擴大,一些細胞毒性T細胞分化為成熟記憶T細胞。即使在原始抗原刺激不存在時,這些細胞依然能夠提供長期免疫記憶保護。
結合循環擴大和免疫記憶特點,抗腫瘤免疫在臨床上表現出「超長待機」的特徵,即伴有較長的DOR(臨床持續緩解)和較長的OS(總生存)。CheckMate 003作為目前PD-1/PD-L1抑製劑隨訪時間最長的臨床研究,5年隨訪數據顯示,晚期非小細胞肺癌患者的5年生存率達16%,相較於目前傳統治療模式下的晚期非小細胞肺癌5年生存率提高了3~10倍(5年OS,非鱗癌4.5%和鱗癌1.6%)。
二非常規應答隨著以免疫檢查點為主的抗腫瘤免疫治療臨床實踐經驗的豐富,更多的臨床問題和特徵也隨之顯現。延遲反應和假性進展作為腫瘤免疫治療的獨特反應模式,受到越來越多的關注。
與傳統靶向和化療直接作用於靶病灶不同,抗腫瘤免疫主要是通過激活機體的免疫系統識別和殺傷腫瘤,需先調動和活化機體的T細胞,經抗腫瘤免疫循環殺傷腫瘤,可能會出現延遲反應的特點。關於晚期非小細胞肺癌的多個III期臨床試驗結果顯示,PD-1/PD-L1抑製劑的起效時間平均為2.1個月左右。
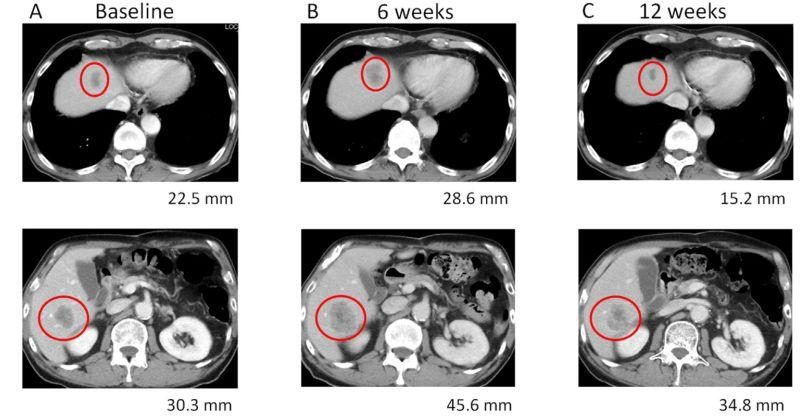
接受免疫治療的患者臨床中可能會遇到這樣的情況:短時間內腫瘤不但沒有縮小,反而增大,堅持治療一段時間,腫瘤很可能又會逐漸縮小,這種情況在醫學上被稱為「假性進展」。隨著使用患者人數的增加和適應證病種範圍的擴大,接受免疫治療的人群中約有5%~10%的患者會發生「假性進展」。
科學家發現腫瘤免疫有「假性進展」的發生,其實質是由於大量的T細胞和免疫調控細胞湧入腫瘤病灶區域,影像學可觀察到腫瘤增大,但是實際上這種腫瘤的增大更多是來源於免疫細胞的聚集,而非腫瘤實質細胞的增加,越多的免疫細胞進入腫瘤病灶區域意味著腫瘤細胞被殺死的概率越大。這一點在今年AACR大會報導的新輔助研究CheckMate159中業已得到證實,在有效患者的靶病灶發現了大量免疫細胞的浸入。
三由於抗腫瘤免疫治療具有以上的特徵,因此如何更加準確和高效地判讀療效則尤為關鍵。實體腫瘤評估目前最為常用的是RECIST 1.1,但對於免疫治療的非常規應答,RECIST評價標準可能並未完全體現出免疫治療患者的受益情況。
免疫療效評價評估標準也經歷了幾次變革和完善,2009年基於WHO標準提出了irRC;2013年基於RECIST標準提出IrRECIST;在irRECIST基礎上,2017年提出了iRECIST標準。在最新的iRECIST判讀標準中,針對疾病進展後的療效評估做了進一步定義。免疫治療PD後,仍可出現iCR/iPR/iSD。首次疾病進展記為iUPD(unconfirmed-PD),iUPD後4~8周需複查,再次被確認的進展才為iCPD(confirmed-PD),即連續兩次評估出現進展才可認定為真進展。
同時,關於腫瘤療效的終點評價指標,腫瘤免疫治療要求綜合全面的評估。OS、PFS、ORR、DOR都是腫瘤療效的評估指標,其中OS是評估腫瘤療效的金標準。只有多種指標的結合才能全面綜合地評估試驗組和對照組的差異。結合抗腫瘤免疫治療的特點,從免疫反應,轉換為抗腫瘤反應,需要一段時間;從抗腫瘤反應,轉換為生存獲益還需要一段時間。如果只是考慮ORR和PFS,很容易低估了免疫治療的療效。
不論是iRECIST標準還是腫瘤臨床試驗的終點指標,更多都是作為系統評估的標準和定義。而在臨床上,如何更為迅速準確地評價免疫治療的效果?其實需要臨床醫生清楚免疫治療特徵並結合臨床表現綜合判斷。往往更多需要考慮患者的綜合表現,如體力狀況,假性進展的患者雖然腫瘤影像學持續增大,但患者體力狀況是穩定或改善的;系統癥狀也會有所改善,如果能夠對病灶進行活檢,假性進展會發現T細胞浸潤。以上特徵都能作為臨床評判免疫治療效果的參考。
機遇與挑戰並存免疫治療並非腫瘤治療的終點,反之,以免疫檢查點為代表的腫瘤免疫治療只是剛剛開啟了腫瘤治療的新篇章。結合免疫治療的基礎和特徵,隨著人類對腫瘤的認知越來越深入,腫瘤作為慢病可治癒都已不再那麼遙不可及。


圖3免疫治療展望—優化
數據來源:Qing Zhou et al. 2017 WCLC
但在腫瘤免疫治療帶來生機的同時,也伴有諸多的疑惑和難題,如免疫療法藥物如何選擇合適的受益人群,各類不良反應乃至副作用何以克服,療效的進一步提升等。假以時機並這一諾獎契機,堅信腫瘤免疫治療有未來,將為腫瘤治療帶來更多的驚喜和希望。
作者介紹

何勇
陸軍軍醫大學大坪醫院呼吸內科 主任醫師
教授、博士生導師
中華醫學會呼吸醫師分會肺癌學組委員
中國醫藥教育協會腫瘤免疫治療專業委員會常務委
此文僅代表作者個人觀點


「南山呼吸」是鍾南山院士倡導下創立,以廣州呼吸健康研究院為認證部門,立足於國內外提供專業的呼吸學科課程、權威的專家學術點評、前沿的呼吸領域資訊、以負責的態度構建交流學習平台。目前獨家欄目有:院士大查房及呼吸學苑。其中院士大查房包括疑難病例專題以及321基層聯動專題,呼吸學苑開設了針對基層醫生的基層呼吸課程、針對專科醫生的南山學院課程以及支纖鏡、肺動脈高壓、呼吸病理、感染、肺部腫瘤等專欄課程。
▼▼▼▼▼