撰文 | 敏君
責編 | 兮
煙醯胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)是生物體氧化還原反應中非常重要的輔酶,它攜帶高能電子,通過可逆性的氧化還原介導氧化磷酸化【1】;並且作為NAD依賴性酶類的底物,將細胞代謝與表觀遺傳調控和DNA損傷修復聯繫起來【2】。NAD水準在衰老過程中逐漸降低,補充NAD前體物質會延緩線蟲、果蠅和小鼠等動物的衰老【3-4】。最近研究發現NAD與腫瘤發生密切相關,NAD會促進衰老細胞分泌促炎因子,刺激腫瘤細胞生長【5】。哺乳動物細胞通過三條途徑合成NAD:一是以色氨酸為原料的從頭合成途徑,二是以煙酸為原料的Preiss-Handler(PH)途徑,三是以煙醯胺(NAM)或煙醯胺核苷為原料的補救合成途徑【6】。到目前為止,決定NAD合成途徑選擇方式的分子機制尚不清楚。
2019年4月25日,來自加州大學聖地亞哥分校Ludwig癌症研究所的Paul Mischel教授團隊在 Nature 雜誌發表文章NAD metabolic dependency in cancer is shaped by gene amplification and enhancer remodelling,揭示了組織-種系起源的癌症其基因擴增和表觀遺傳重塑依賴於NAD途徑,表明靶向NAD代謝進行基因型選擇、藥物可操作依賴是進行癌症精準治療的潛在途徑。


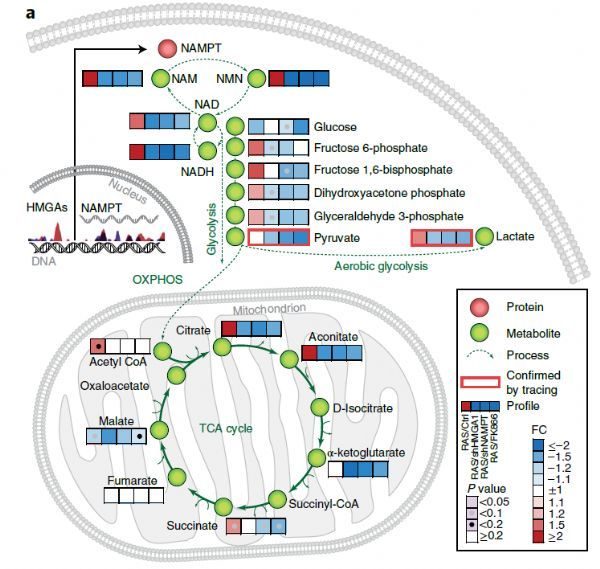
作者對216例癌症研究的63,856個樣品進行了分析,結果表明PH合成途徑、補救合成途徑和NAD從頭合成途徑的限速酶——煙酸鹽磷酸核糖轉移酶(NAPRT)、煙醯胺磷酸核糖轉移酶(NAMPT)和喹諾酸鹽磷酸核糖轉移酶(QAPRT)(圖1),在腫瘤發生中的突變頻率不到1%。然而,NAPRT和NADSYN1的DNA拷貝數在包括攝護腺癌、卵巢癌和胰腺癌等許多類型癌症中均有所增加,作者發現組織微環境決定了某些特定類型的腫瘤組織NAPRT發生擴增。


圖1 NAD
非腫瘤細胞能夠利用所有的NAD合成途徑以維持胞內NAD水準,用NAMPT特異性抑製劑和小RNA干擾(siRNA)分別抑製三條NAD合成途徑,並不影響非癌細胞的存活。相反,具有NAPRT擴增和/或NADSYN1基因擴增(PH擴增)特徵的29種癌細胞系的存活全部依賴於NAPRT和NADSYN1,而25種無PH擴增的細胞系的存活均不依賴於NAPRT和NADSYN1兩種蛋白。針對NAD從頭合成關鍵酶或PH和補救途徑的shRNAs干擾實驗證實,PH擴增的癌細胞完全依賴於PH途徑來維持NAD合成和細胞存活。相比之下,非PH擴增的癌細胞系則完全依賴於NAMPT和補救合成途徑。
為檢測組蛋白H3第27位賴氨酸的乙醯化(H3K27ac)水準,作者進行了ChIP-seq,發現位於7號染色體NAMPT轉錄起始位點下遊65kb處,有一個遠程NAMPT增強子,該增強子具有補救途徑依賴性的H3K27ac特異性標記和/或DNase I超敏感(DNase I hypersensitive site, DHS)信號,而在PH擴增的癌細胞或正常細胞系中均不存在。將該4.641 kb的順式調控區域克隆至NAMPT啟動子上遊或下遊,該區域在依賴補救途徑的癌細胞系中表現出潛在的增強子活性,而不影響PH擴增性或非癌細胞系。對該預測的增強子進行精細定位,發現增強子「B」區域對於NAMPT增強子活性是必需的。CRISPR干擾實驗表明增強子「B」能夠控制NAMPT基因表達;是H3K27乙醯化作用的靶標;能調控細胞內NAD水準;是補救途徑依賴性癌細胞以NAD依賴性方式存活所不可或缺的。ChIP-qPCR和熒光素酶報告基因檢測表明c-MYC和MAX轉錄因子能在補救途徑依賴性癌細胞中特異性調節NAMPT增強子活性。
NAPRT擴增性腫瘤細胞專一性地利用PH途徑調節NAD穩態並維持生存。聯合抑製NAMPT和NMRK1會導致腫瘤內NAD水準下降,導致腫瘤完全性和持久性的退化,以及體內大量癌細胞死亡,證明了在非PH擴增性腫瘤治療中需聯合抑製NAMPT和NMRK1蛋白。
為確定腫瘤發生中的NAD生物合成依賴性是否具有藥理學上的可行性,作者利用細菌NADSYN1抑製劑NADSYN1i處理不同的腫瘤組織,發現NADSYN1i能抑製人原NADSYN1活性,並能選擇性抑製PH擴增性癌細胞系的生長和NAD水準,而對正常細胞和非PH擴增性細胞系沒有明顯影響。此外,NADSYN1i能顯著性抑製NAPRT擴增性OV4卵巢瘤生長,並能降低小鼠瘤內NAD水準,但對補救途徑依賴性的H460肺癌的生長和腫瘤內NAD水準影響很小。與之相反,MAMPT抑製劑FK-866能在體外選擇性抑製補救途徑依賴性腫瘤細胞系和小鼠H460肺癌的生長,但在體內對PH擴增性OV4卵巢瘤沒有影響。此外,腫瘤發生過程中可能會發生進一步的變化,以促進NAD通路的選擇習慣性(圖2)。


圖2 腫瘤中NAD代謝的分子基礎
如何將有關癌症代謝的生化和遺傳圖景轉化為有效的臨床治療,是目前醫學界面臨的一個巨大挑戰。局部組織微環境、種系依賴性的轉錄調控和腫瘤細胞基因型改變是腫瘤發生的重要影響因素,且三者間存在著複雜的相互作用,但這種相互作用如何影響癌細胞賴以生存的特定酶類,目前尚不清楚。本研究中,作者證明了腫瘤發生過程中對NAD通路的依賴性和選擇性是由基於組織譜系的基因擴增和表觀基因重塑決定的,揭示了基因型選擇的藥理學操作依賴性可被用於開發針對NAD代謝的更有效、更精確的癌症治療方法。
原文鏈接:
製版人:珂
參考文獻
1. Ryu, K. W., Nandu, T., Kim, J., Challa, S., DeBerardinis, R. J., & Kraus, W. L. (2018). Metabolic regulation of transcription through compartmentalized NAD+ biosynthesis. Science, 360(6389), eaan5780.
2. Vander Heiden, M. G. & DeBerardinis, R. J. (2017). Understanding the intersections between metabolism and cancer biology. Cell 168, 657–669.
3. Mouchiroud, L., Houtkooper, R. H., Moullan, N., Katsyuba, E., Ryu, D., Cantó, C., ... & Guarente, L. (2013). The NAD+/sirtuin pathway modulates longevity through activation of mitochondrial UPR and FOXO signaling. Cell, 154(2), 430-441.
4. Yoshino, J., Mills, K. F., Yoon, M. J., & Imai, S. I. (2011). Nicotinamide mononucleotide, a key NAD+ intermediate, treats the pathophysiology of diet-and age-induced diabetes in mice. Cell metabolism, 14(4), 528-536.
5. Nacarelli, T., Lau, L., Fukumoto, T., Zundell, J., Fatkhutdinov, N., Wu, S., ... & Noma, K. I. (2019). NAD+ metabolism governs the proinflammatory senescence-associated secretome. Nature cell biology, 21(3), 397.
6. Katsyuba, E., Mottis, A., Zietak, M., De Franco, F., van der Velpen, V., Gariani, K., ... & Giacchè, N. (2018). De novo NAD+ synthesis enhances mitochondrial function and improves health. Nature, 563(7731), 354.
BioArt,一心關注生命科學,只為分享更多有種、有趣、有料的信息。關注投稿、合作、轉載授權事宜請聯繫微信ID:bioartbusiness 或郵箱:[email protected]。原創內容,未經授權,禁止轉載到其它平台。