腫瘤,迥異的發病機制、僅次於心血管的高死亡率,成為了研發的風口、市場的主流。市場容量2017年首破千億,無葯能及;整體年增幅12%,遠高於平均值的6%,備受矚目。
而腫瘤市場中熱門靶點無疑又是其中的佼佼者,在臨床療效、市場表現都表現卓越,受到了患者、專業人士的青睞。
上一期我們盤點了腫瘤市場十大熱門靶向藥物和療法點中的(PD-1抑製劑、HER2抑製劑、CDK4/6抑製劑、BTK抑製劑、VEGF/VEGFR抑製劑),這一期我們著重介紹(CAR-T療法、EGFR抑製劑、ALK抑製劑、PARP抑製劑與ADC抗體偶聯藥物),了解它們的作用機制、臨床療效、市場走向……
一
CAR-T療法
CAR-T,全稱chimeric antigen receptor T-cell immunotherapy,即嵌合抗原受體T細胞免疫療法;原理是通過在T細胞表面表達嵌合抗原受體,改變淋巴細胞的特異性和功能。
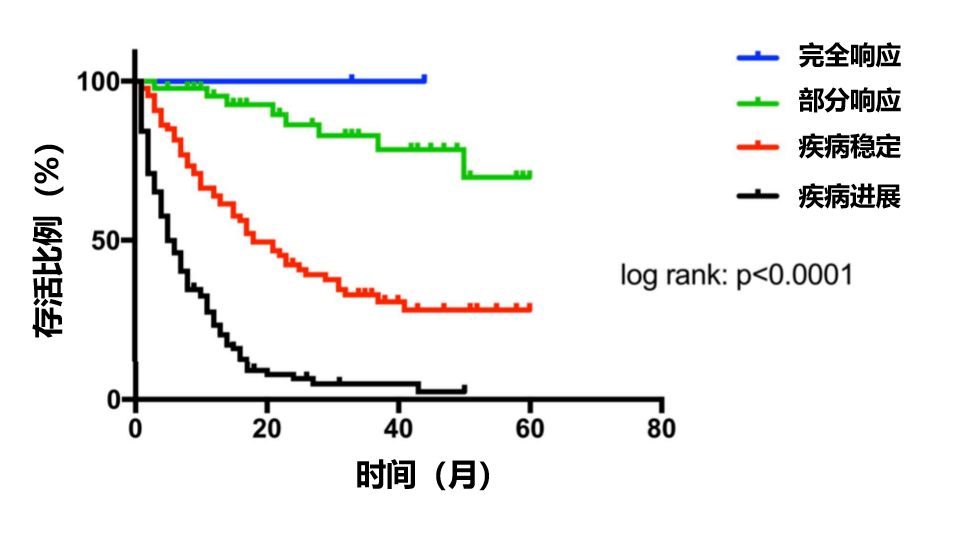
腫瘤細胞能夠降低抗原的表達等方式,使得T細胞無法通過人類白細胞抗原(human leukocyte antigen, HLA)依賴的方式被激活,從而腫瘤能夠達到免疫逃逸,進而發展成惡性腫瘤。CAR-T療法就是通過生物技術手段,在T細胞表達出能夠特異性識別腫瘤抗原的抗體,從而能夠激活人體免疫系統對於腫瘤細胞的殺傷。CAR-T療法憑藉在血液瘤極高的響應率,甚至達到了完全治癒,成為了眾多葯企布局的焦點。
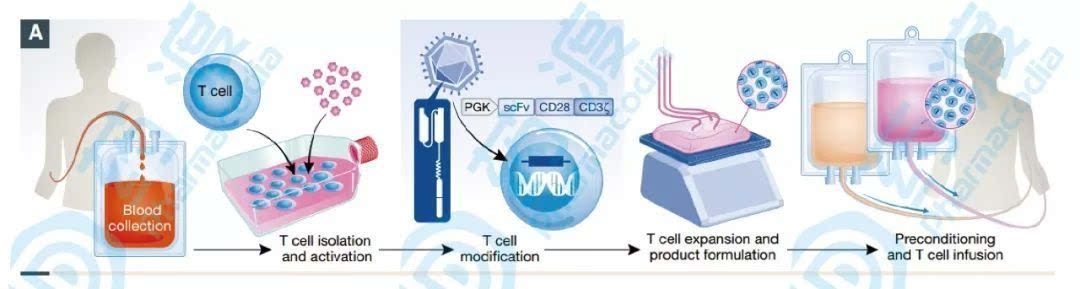

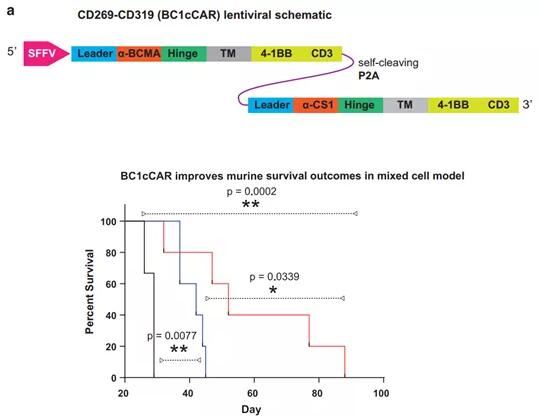
圖1. CAR-T原理和工作流程
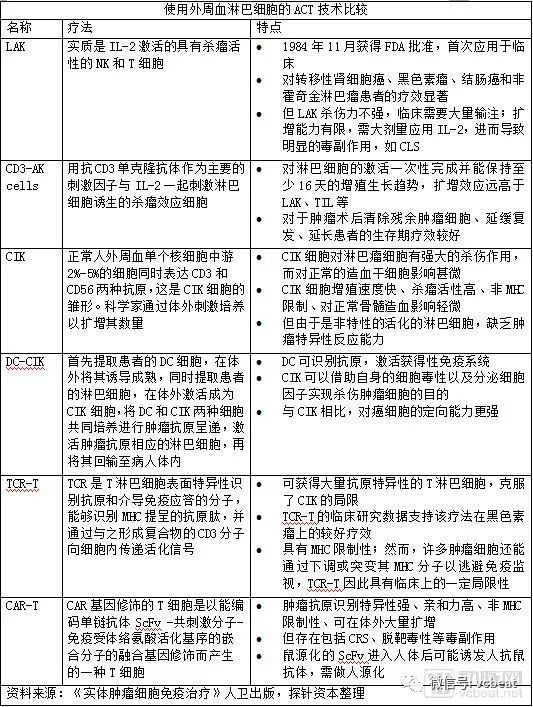
由於CAR-T療法的高靈敏度,和傳統抗體藥物相比,靶向/脫靶毒性會導致更為嚴重的毒副作用,因此,CAR-T治療的靶點需要尋找更為嚴格的腫瘤特異性抗原作為靶點,如CD19、CD20、HER2、BCMA、EGFR等。
整體發展來看,第二代CARs結合了激活和共刺激信號,如CD28、4-1BB等,彌補了第一代缺乏共刺激信號,CAR-T細胞卻無法有效擴增,療效不佳的問題,第二代CARs是如今研發的主流。諾華和吉利德的CAR-T療法都是基於第二代CARs。
第三代CARs相比第二代多結合了一個共刺激信號,主要是為了彌補第二代CAR在T細胞增殖和持續性無法兼備的問題。第四代CARs在保留了第三代兩個共刺激和激活信號的基礎上,還進一步引入了分泌細胞因子的基因,來進一步增強對腫瘤的殺傷作用。


圖2. CAR-T技術的發展歷程
雖然CAR-T療法目前在血液瘤表現出了顯著的療效優勢,不過在臨床使用和市場擴展方面依舊存在不小的問題。
1、CAR-T治療由於過度激活免疫系統,容易引起較為嚴重的細胞因子風暴毒副作用。
2、治療實體瘤方面,目前發現的新靶點還存在不同的缺陷。
3、腫瘤細胞除了降低腫瘤抗原的表達,同時還會在腫瘤的微環境中抑製T細胞的活化,這也是實體瘤發展緩慢的原因。
4、目前CAR-T療法使用的都是自體細胞,導致製備流程上的困難和不同患者之間的療效差異性,治療費用高昂。
作為新興的細胞療法,CAR-T療法的上市可謂是一波三折,幾近夭折。不過極高的響應率也吸引著眾多葯業的介入,如何擴展適應症、選取合適的靶點、工藝成熟、降低治療費用將成為CAR-T療法未來需要解決的問題。