Unum淋巴瘤臨床研究遭叫停 國產「偉哥」獲批
藥品研發
1、羅氏旗下基因泰克公司創新流感療法Xofluza在名為MINISTONE-2的全球性3期臨床試驗中達到主要終點。在治療1-12歲兒童流感患者時表現出良好的安全性,同時顯著縮短流感癥狀。
2、羅氏公司近期宣布其第三階段MINISTONE-2臨床試驗達到主要終點,表明Xofluza(巴羅沙韋,marboxil)與達菲(奧司他韋, Tamiflu)相當,對流感患兒有良好的耐受性。
3、法國Valbiotis公司公布了Valedia IIA期臨床研究的積極頂線數據。該研究在糖尿病前期人群中開展,評估了Valedia相對於安慰劑的療效和安全性。結果顯示,在該群體中,與安慰劑相比,Valedia顯著降低了空腹血糖和餐後血糖水準。
4、再鼎醫藥和Incyte公司就一款處於臨床階段的抗PD-1單克隆抗體INCMGA0012在大中華區的開發和商業化簽訂了獨家合作和授權許可協議。
5、諾華重磅偏頭痛產品Aimovig兩項III期臨床的最新數據公布,STRIVE試驗表明Aimovig顯著降低了每月偏頭痛天數和每月需要急性偏頭痛藥物治療天數,LIBERTY試驗證明了Aimovig改善患者生活質量的長期療效。
6、渤健公布了治療脊髓性肌肉萎縮症(SMA)的反義寡核苷酸療法Spinraza,在SMA嬰兒未出現癥狀前開始治療的長期療效結果。試驗結果表明,經過長達45.1個月的隨訪和數據分析,Spinraza能夠幫助嬰兒達到疾病自然發展歷史上無法達到的運動能力里程碑,其中包括100%的兒童能夠不需協助坐起來,88%的兒童能夠自主行走。
7、輝瑞發布了杜氏肌營養不良症基因治療的早期臨床數據,新數據引起了外界對其安全性問題的擔心,接受治療的前六人中有一人患急性腎損傷而住院治療。
8、勃林格殷格翰和韓國醫藥公司柳韓洋行聯合宣布一項合作和許可協議。兩家公司將合作開發治療非酒精性脂肪性肝炎和相關肝臟疾病的創新雙重激動劑,該激動劑將GLP-1和FGF21活性彙集在一個分子中。
9、日前,FibroGen公司公布了治療杜興氏肌營養不良症的在研藥物pamerevlumab,在治療非臥床患者的2期臨床試驗的中期結果。結果表明,pamrevlumab與患者歷史數據相比,能夠緩解患者肺功能和心臟功能的下降。
10、近日,SpringWorks公司與葛蘭素史克公司達成一項臨床研究合作協議。根據協議,SpringWorks公司的在研產品γ分泌酶抑製劑nirogacestat將與葛蘭素史克研發的抗B細胞成熟抗原抗體偶聯藥物belantamab mafodotin聯合使用,評估這一組合治療複發/難治性多發性骨髓瘤的效果。
11、日前,Bicycle Therapeutics公司宣布,治療糖尿病黃斑水腫的在研療法THR-149在合作夥伴Oxurion開展的1期臨床試驗中獲得積極結果。THR-149是一款基於雙環多肽的創新血漿激肽釋放酶抑製劑。這款創新抑製劑不但表現出良好的安全性和耐受性,而且顯著提高患者的視力。
葯 品 審 批
FDA1、專註於胃腸道疾病的生物醫藥公司RedHill Biopharma宣布,FDA接受了其創新幽門螺桿菌清除療法Talicia的新葯申請,並且授予其優先審評資格。
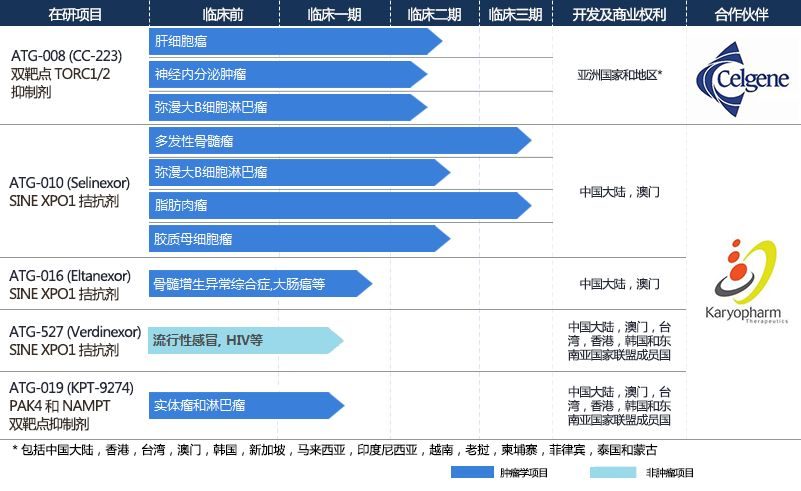
2、美國FDA批準德琪醫藥與Karyopharm,合作開發的全球首款核輸出抑製劑XPOVIOTM與低劑量地塞米松聯合用於治療複發難治多發性骨髓瘤。
3、Iovance Biotherapeutics公司公布了腫瘤浸潤淋巴細胞療法LN-145治療晚期宮頸癌的最新研發信息。在與FDA進行討論之後,FDA認為正在進行的單臂2期臨床試驗innovaTIL-04的研究結果可以支持LN-145治療晚期宮頸癌的監管申請。
4、康方生物宣布,自主研發的PD-1/VEGF雙特異抗體新葯AK112獲得美國FDA頒發的藥物臨床試驗批件。
5、吉利德科學就在研口服高度選擇性JAK1抑製劑filgotinib,與FDA進行了新葯申請提交前的會議。吉利德向FDA提供了filgotinib的最新試驗結果,包括治療類風濕性關節炎的3期臨床試驗FINCH以及2期安全性臨床試驗MANTA的結果。
6、近日,Unum Therapeutics公司候選藥物ACTR087治療淋巴瘤的I期臨床研究因不良事件遭到美國FDA叫停。該研究在複發性或難治性CD20陽性B細胞非霍奇金淋巴瘤患者中開展,評估了ACTR087聯合利妥昔單抗用於患者接受氟達拉濱及環磷醯胺淋巴消耗性化療後的治療。
7、美國FDA批準Grifols公司Xembify,用於治療2歲及2歲以上患者的原發性免疫缺陷病,這是一款新的20%皮下免疫球蛋白產品。
NMPA
1、近日,國家藥品監督管理局有條件批準達雷妥尤單抗注射液進口註冊申請,用於單葯治療複發和難治性多發性骨髓瘤成年患者,包括既往接受過一種蛋白酶體抑製劑和一種免疫調節劑且最後一次治療時出現疾病進展的患者。
2、復星醫藥公布,按國家葯監局藥品審評中心發布的公示信息,控股子公司上海復宏漢霖生物技術的注射用曲妥珠單抗已納入優先審評程序。該葯主要用於轉移性乳腺癌適應症及轉移性胃癌適應症等。
3、中國生物製藥發布公告稱,附屬公司南京正大天晴製藥有限公司開發的藥物他達拉非片獲得國家葯監局頒發藥品註冊批件,為國內同品種第二個獲批的仿製葯。
4、中國生物製藥發布公告,附屬公司正大天晴葯業集團股份有限公司自主研發的抗腫瘤葯「鹽酸安羅替尼膠囊」,繼去年獲批上市後,獲國家葯監局頒發藥品註冊批件,批準新增適應症「軟組織肉瘤」。
5、南京正大天晴3類仿製葯「替格瑞洛」正式獲國家葯監局批準上市,成為該品種第3家獲批上市的國內企業。
6、禮來中國宣布,國家藥品監督管理局批準了艾樂明?(巴瑞替尼片)2mg片劑用於治療成人中重度活動性類風濕關節炎。
7、近日,葛蘭素史克在中國提交的注射用貝利尤單抗上市申請獲得國家葯監局批準,意味著這款創新性的系統性紅斑狼瘡新葯不久後就可在中國上市。
8、步長製藥發布公告稱,控股子公司山東丹紅製藥有限公司的注射用重組人腦利鈉肽臨床試驗申請獲國家藥品監督管理局核準簽發的受理通知。
9、近日,中關村子公司北京華素製藥收到國家葯監局核準下發的《藥品補充申請批件》,華素製藥所屬產品富馬酸比索洛爾片(2.5mg)首家通過仿製葯質量和療效一致性評價。
9、興齊眼藥收到國家葯監局下發的《審批意見通知件》,通知顯示,公司提交的硫酸阿托品滴眼液(規格:0.4ml:0.04mg)的註冊申請未獲得國家葯監局的批準,原因是參比製劑的安全有效性不充分。
其他1、Alexion Pharmaceuticals日前宣布,歐盟委員會已批準Ultomiris?用於治療陣發性睡眠性血紅蛋白尿的成年患者, 這是第一種也是唯一一種每八周給葯一次的長效C5補體抑製劑。
2、歐盟委員會已批準ViiV Healthcare公司Dovato,用於治療年齡在12歲以上、體重≥40公斤、並且對整合酶抑製劑或拉米夫定沒有已知或疑似耐葯的青少年和成人HIV-1感染者。
3、賽諾菲和再生元宣布,歐盟已授予Libtayo?有條件上市許可,用於治療患有轉移性或局部晚期皮膚鱗狀細胞癌的成人。此類患者不適合治療性手術或放射性治療。
編輯:Acroypc


一周葯聞
彙集醫藥人關注的資訊