2020年,科學領域迎來新技術,即基因魔剪,也就是基因編輯。人類不斷探索新治療方法來開發新藥,基因技術也就越來受到科學家的重視。今年兩位女性研究人員因基因編輯工具CRISPR/Cas9,拿下了2020年諾貝爾化學獎。值得一提的是,CRISPR/Cas9也正應用於B肝新藥開發。

B肝在研新藥CRISPR,永久性使cccDNA失活,治愈感染
業內也將基因編輯,稱為基因剪刀,這種技術能夠精確識別靶細胞的DNA片段裡面的靶點核苷酸序列,運用核酸內切酶蛋白實現對DNA靶點序列的切割。這種基因剪刀所實現的上述過程,可以達到對靶細胞DNA目的基因片段的精確編輯。目前,這種新技術正運用於抗腫瘤、白血病等領域開發新藥,而CRISPR/Cas基因編輯新技術,也有望在慢性B肝新藥研發方向帶來機會。
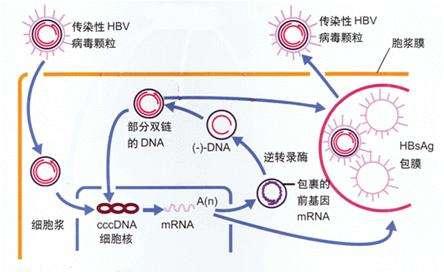
簡單的講,基因編輯策略可能成為B肝病毒複製原始模板cccDNA形成抑製劑。它能夠沉默或耗盡感染肝細胞中的cccDNA庫,是目前慢性B肝治療的新療法。近年來,靶向突變引起了醫藥學界的廣泛興趣。因為這是通過使用序列特異性RNA,引導核酸酶(RGNs)和蛋白質作為治療HBV感染的一種手段,通過永久性地使cccDNA失活來治愈HBV感染。

2020年10月1日發表於《Journal of Clinical Medicine》雜誌的一份研究報告,由希臘雅典和卡波迪斯特裡安大學醫學院醫學部研究人員主導完成,其中重點介紹了這種基因編輯策略:cccDNA形成抑製劑。在核酸酶(RGNs)家族中,包括鋅指核酸酶(ZFNs)、轉錄激活物樣效應器核酸酶(TALENs)以及具有CRISPR相關(Cas)系統的簇狀間隔短回文重複序列(CRISPR),所有這些都顯示出抗病毒功效。
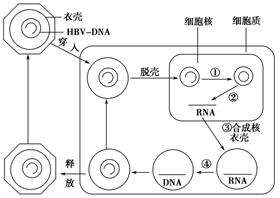
希臘研究人員指出,B肝病毒複製模板cccDNA是一種穩定的非整合小染色體,包裹在轉錄活性和非活性染色質中。通過設計核酸酶,可以在HBV基因組中預定序列上裂解,從而導致預先確定的突變。雖然突變的cccDNA可以被轉錄,但由此產生的突變病毒蛋白不能再參與病毒複製。因此,B肝病毒複製模板cccDNA是核酸酶基因編輯的最佳靶點,因為它具有上位微染色體結構和序列穩定性。

在基因編輯領域更具體的應用來講,2020年獲得諾內爾化學獎的兩位女性科學家開發的CRISPR/Cas9,是對cccDNA的切割和失活以及對肝癌的抑製作用都已經被報導。作用機制上,表觀遺傳修飾,使積極轉錄的DNA在不改變核苷酸序列的情況下,轉錄為非轉錄狀態。DNA結合域引導表觀遺傳效應器到cccDNA的預定序列,以便進行靶向修飾。
在組蛋白修飾和cccDNA甲基化,可通過直接影響cccDNA或相對應的組蛋白而引起表觀遺傳改變。組蛋白乙酰化或去乙酰化、組蛋白甲基化或去甲基化、cccDNA甲基化和cccDNA小染色體乙酰化構成潛在的表觀遺傳修飾。研究人員指出核心要點,即潛在的HBV-DNA修飾物包括組蛋白乙酰轉移酶/脫乙酰基酶(HATs/HDACs)、賴氨酸甲基轉移酶、蛋白質精氨酸甲基轉移酶和DNA甲基轉移酶(DNMTs),與病毒因子如HBx和HBcAg發生了協同作用。
特別是HBx長期以來被認為是cccDNA轉錄和病毒複製所必需的,這種新基因編輯技術通過降解Smc5/6作為限制因子。在這方面,HBx構成了一個合理的靶點,對其的干擾可能會阻止HBx與病毒相關細胞相互作用之間的額外相互作用。在以往文獻中,科學界提出一種新的一級分子cccDNA失穩劑,它可以靶向先前存在的B肝病毒基因組庫。

小番健康結語:不要小看這種小分子,研究顯示,這種小分子顯示出對血清中B肝表面抗原、e抗原、HBV-DNA和HBV-RNA水準具有強大和持續的抑製作用,並且通過循環DNA轉導調降小鼠模型肝髒中cccDNA水準,這種循環DNA能夠使用類似於人類的cccDNA依賴機制複製HBV。2020年諾貝爾化學獎授予兩位女性科學家,她們開發了新基因編輯技術CRISPR/Cas9。
CRISPR/Cas9,已在2020年歐洲肝髒學術年會(EASL 2020)和2020年美國肝髒研究年會(AASLD 2020)前夕向科學界發表關於該領域科研進展(2020年10月1日 Journal of Clinical Medicine)(文末附:截至2020年10月1日部分全球慢性B肝新藥研發進度表,不包括臨床前數據。僅包括過去兩年內完成的臨床試驗。數據來自美國臨床試驗數據庫)。

責任編輯: