來自論壇討論的一個帖子:
臨床上把具有大量蛋白尿(> 3.5 g/24h)伴有低白蛋白血症、水腫、高脂血症(高甘油三酯血症及高膽固醇血症)及脂質尿等表現的一類疾病稱之為腎病綜合征(nephrotic syndrome,NS)。
一些原發性腎小球疾病(如微小病變性腎病[MCD]、局灶節段性腎小球硬化[FSGS]以及膜性腎病等)以及系統性疾病(如糖尿病、系統性紅斑狼瘡以及澱粉樣變性)都可以表現為腎病綜合征。
雖然病因各不相同,但這部分患者在病理生理、臨床表現、併發症、治療等方面具有一些共同特點。對這些「共性」的研究一直是腎臟病學者關注的熱點。
一直以來,我們的教科書上對於腎病綜合征的診斷標準幾乎沒有太大變化:
①大量蛋白尿:>3.5g/d
②低白蛋白血症:<30g/L
③水腫
④血脂升高
其中的①②兩項為診斷必須
關於大量蛋白尿的標準,目前採用的是成年人要超過 3.5 g/d,但是對於兒童,腎病範圍的蛋白尿定義為尿蛋白排泄率 >40 mg/h/m2(國內一般按50 mg/(kg·d)計算)
腎病綜合征的臨床表現中最核心的始動因素是大量蛋白尿,其他所有的臨床表現都是在蛋白尿達到一定程度(閾值)之後方才出現。
教科書上,關於腎病綜合征這幾點(大量蛋白尿、低蛋白血症、水腫及高脂血症)的發病機制很多年都沒有太大變化。事實上,在過去的幾十年中,對上述各個表現的研究都取得了一定的進展。
來自伯明翰 Alabama 大學的 Sumant S. Chugh 教授結合腎病綜合征最新的一些研究成果,著重闡述了蛋白尿形成的分子基礎及其和其他臨床表現之間的內在關係、腎病範圍蛋白尿閾值、高甘油三酯血症的發病機制等。
基於這些研究成果開發出來的治療手段,已經成功的應用於蛋白尿的治療,效果顯著,讓我們一起來分享這篇文章。
蛋白尿
書上講蛋白尿的形成主要和腎小球濾過膜的分子屏障以及機械屏障受損、對蛋白質通透性增加有關。
但這個已經不能滿足日益增長的實際需要。目前對於蛋白尿的研究已經深入到了分子層面,足細胞的損傷及異常是導致蛋白尿的關鍵因素,這一點已經基本得到共識。
足細胞表達的部分基因直接或間接參與了蛋白尿的形成。
按這些基因表達的蛋白質可分為:裂孔膜相關蛋白、細胞基質界面相關蛋白、細胞骨架相關蛋白、足細胞表面蛋白、轉錄因子以及足細胞分泌蛋白(經典的分法是:裂孔膜蛋白、頂膜蛋白、骨架蛋白以及基底膜蛋白)。
這其中的許多結構蛋白都是在檢測疾病基因突變時發現的(如在常染色體隱形遺傳的芬蘭型先天性腎病綜合征中發現編碼 nephrin 的 NPHS1 基因突變,跨膜蛋白 nephrin(NPHS1)是編碼裂孔膜的主要成分。
在家族性常染色體隱性遺傳 FSGS 中發現編碼 podocin 的 NPHS2 基因突變,podocin(NPHS2)僅表達於足細胞,主要位於裂孔膜插入處),在這些以蛋白尿為主要表現的疾病中,相關基因突變是具有特徵性的變化。
還有部分是在研究老鼠的基因突變時發現的(如 neph1)。在絕大多數情況下,僅僅這些基因的改變並不能解釋蛋白尿的形成。鋅指蛋白的作用就是在研究不同基因表達的動物模型中發現的。
在足細胞分泌的蛋白中,和蛋白尿形成密切相關的是血管生成素樣蛋白-4(Angptl4)和血管內皮生長因子(VEGF),這一點已經通過實驗模型得到證實。
關於 Angptl4 在腎病綜合征蛋白尿中的研究大多來源於 MCD,足細胞分泌的低唾液酸化 Angptl4 直接導致 MCD 蛋白尿形成,並且和 MCD 一系列重要的臨床特點密切相關:對糖皮質激素敏感、選擇性蛋白尿、腎小球基底膜(GBM)電荷屏障受損以及組織形態學改變。
儘管 MCD 的 GBM 電荷屏障消失和 Angptl4 有關,但蛋白尿的發生是否和 GBM 電荷屏障的急性消失有關仍未明確,Angptl4 和硫酸乙醯肝素蛋白多糖或 GBM 上其他蛋白之間複雜的相互作用也不是很清楚。
Angptl4 是這篇文章介紹的重中之重,我們對此都很陌生,結合手頭的資料先簡單介紹一下這個腎病綜合征領域新明星。
血管生成素樣蛋白-4(Angiopoietin-like 4,Angptl4),也被稱為禁食誘導的脂肪因子(FIAF),過氧化物體增殖體激活受體 γ 血管生成素相關蛋白(PGAR)或者肝臟纖維蛋白原/血管生成素樣相關蛋白(HFARP)。人類 Angptl4 在肝臟、脂肪組織、血漿、胎盤、小腸和心臟組織廣泛表達,在下丘腦、垂體有少量表達。有意思的是,不同來源的脂肪組織表達並不一致:Angptl4 只在內臟脂肪組織表達,而在皮下脂肪組織和乳房脂肪組織不表達。
Angptl4 蛋白參與人體中許多病理生理過程,包括脂質代謝、糖代謝、腫瘤等,在本文我們重點關注的是其對於脂質代謝以及蛋白尿的作用。人 Angptl4 基因位於 19p131,有 7 個外顯子,編碼包含 406 個氨基酸的糖蛋白,蛋白的相對分子質量為 45-65 kDa。Angptl4 蛋白具有分泌型的信號肽結構,包括 N 端螺旋捲曲的四級結構(nAngptl4)和 c 端纖維蛋白原樣結構域(cAngptl4),還有三個能被唾液酸化的糖基化位點。
體內的 Angptl4 蛋白主要以全長和截斷蛋白兩種形式存在,截斷蛋白的分泌具有組織依賴性,肝臟分泌的是截斷的 nANGPTL4,脂肪組織分泌的則是全長蛋白,它們的基礎表達水準因人而異。全長 Angptl4 蛋白可以水解成 nAngptl4 和 cAngptl4。上述兩種截斷蛋白形式是 Angptl4 蛋白在體內發揮重要生理功能必不可少的,例如,抑製 LPL 的主要是 nAngptl4,而 cAngptl4 則和整合素 β1、β5 以及胞外基質蛋白相互作用。Angptl4 的表達受多種因素影響,包括禁食、缺氧、熱量限制、攝入非酯化脂肪酸、懷孕和哺乳、TGF-β、PPAR-α 激動劑(非諾貝特)、PPAR-γ 激動劑(曲格列酮)、HIF-1α 激動劑(NiS04)、糖皮質激素(地塞米松)、PKC 激動劑(PMA)、血管緊張素受體阻斷劑(纈沙坦)、生長因子 VEGF 等。
Angptl4 在腎病綜合征中的作用主要來自對 MCD 的研究。有幾個有意思的現象:
①通過基因轉染使鼠足細胞特異性高表達 Angptl4,經過一段時間後發現尿蛋白明顯增加,腎組織行病理檢查提示 MCD 樣改變,GBM 電荷減少,免疫電鏡提示Angptl4穿過基底膜從足細胞(外)向內皮方向沉積(內)。
②MCD 患者足細胞、外周血、尿液中的Angptl4均升高。
③通過轉基因技術使鼠脂肪組織特異性高表達 Angptl4 後,此時雖然外周血 Angptl4 是升高的,但是不會出現蛋白尿,腎臟病理檢查也基本正常。
而足細胞分泌的另外一個和蛋白尿有關的蛋白是血管內皮細胞生長因子,主要參與了人血栓性微血管病(TMA)的發生。除足細胞分泌蛋白外,血漿中可溶性尿激酶受體濃度升高也參與了FSGS的發病。
足細胞分泌的蛋白(如 Angptl4)可以「橫穿」GBM,和腎小球內皮細胞表面的「受體」相結合,參與腎小球局部反饋環。
最新的研究發現,在蛋白尿達到腎病範圍時,機體會作出一系列的反應來降低蛋白尿,即系統反饋環。
主要由脂肪組織、骨骼肌及心臟分泌唾液酸化的 Angptl4 入血來降低蛋白尿,這個作用至少部分是通過與腎小球內皮細胞上的 αⅤβ5 整合素相結合來實現的。
這個機制體現了病理狀態下「一方有難,八方相助」的機體自身調節機制,為研究蛋白尿時的全身系統變化打開了一個新的窗戶。Angptl4 就是這樣一個聯繫的橋樑。
目前已經清楚,足細胞分泌的低唾液酸化 Angptl4 是 MCD 蛋白尿發生的原因,也是糖尿病腎病蛋白尿形成的重要因素。
看到此處,有一個疑問:前面先說 Angptl4 是引起 MCD 蛋白尿的原因,這裡又說脂肪組織/心臟/骨骼肌這些分泌的 Angptl4 可以降低蛋白尿?是不是矛盾?
各位莫急,繼續往下看,且看且思考!
水腫
腎病綜合征患者水腫的出現形式各不相同:在一些 FSGS 或MN中呈急性或亞急性出現;而在 MCD 中可以表現為爆發性,一夜之間腫起來;甚至在一些 HIV 相關的塌陷型腎小球病患者中可以全無水腫的表現。
水腫的影響因素很多,不同臨床情況下,病因不同,水腫的表現也是各異,從病理生理的角度來講,水腫的發生和低白蛋白血症、原發性腎性鈉瀦留以及外周毛細血管通透性增加有關。
低蛋白血症和水腫之間的關係就不再贅述了,這一點大家都很清楚,隻提一點,除非為全身難治性水腫,否則一般不建議採用輸注白蛋白的方式消腫。
原發性腎性鈉瀦留,主要發生在腎小管(更準確的講,在遠曲小管和皮質集合管頂端之間)。
Na+-K+-ATP 酶和選擇性的鈉通道(ENaCs)可能是鈉重吸收的關鍵所在,但是其具體如何調節目前還不清楚。最近的研究表明,經腎小球濾過的纖溶酶原轉變為纖溶酶後,可以介導集合管上皮細胞鈉通道的蛋白水解酶活化。
我們知道利尿劑治療最重要的靶點就是腎小管,按利尿效果強弱的次序,髓襻升支粗段、遠端腎小球、集合管、近端小管上的轉運體,都可以作為水腫治療的靶點。
我們對水腫理解最少的可能就是外周毛細血管通透性的增加,且目前沒有任何一個針對性治療手段。作者非常看好這個領域的研究前景,認為有可能對難治性水腫的治療有幫助。
相對而言,後面 2 點才是大家容易疏忽的。
高脂血症
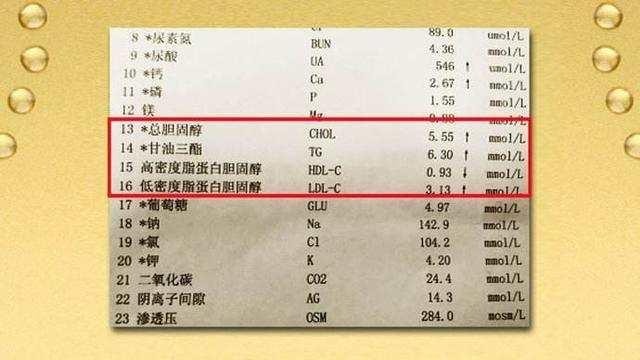
腎病綜合征的高脂血症包括高膽固醇學者以及高甘油三酯血症,教科書上隻說高脂血症的形成和脂蛋白合成增加以及分解減少有關。
膽固醇的增加用腎病綜合征低蛋白血症刺激肝臟代償性過度合成脂蛋白來解釋。
事實上,教科書上講的另外一句話現在看來更加符合目前對高脂血症的認識:脂蛋白分解減少可能是高脂血症形成更加重要的原因。
1. 高膽固醇血症
腎病綜合征患者總膽固醇及低密度脂蛋白(LDL)升高主要是獲得性 LDL 受體缺陷所致(LDL 主要生理作用是轉運內源性膽固醇,LDL 受體缺陷使得富含膽固醇的 LDL 從血液中清除減少)。
這種受體缺陷發生在哪個環節?
目前還不是很清楚,但發現在腎病綜合征患者的肝臟可以表達正常 LDL 受體的 mRNA,這表明 LDL 受體缺陷發生在轉錄之後的環節。
另外一個現象就是,近期的動物模型發現,腎病綜合征患者肝臟可以通過蛋白質原轉換酶枯草桿菌蛋白酶/kexin9(PCSK9)(為一種絲氨酸蛋白酶)增加 LDL 受體降解(PCSK9 與 LDL 受體結合,導致後者降解加速)。
LDL受體缺陷導致細胞外膽固醇的攝取減少,機體肯定要通過其他方法來彌補這一塊缺失的膽固醇。
目前發現主要是通過上調肝臟合成膽固醇的關鍵酶——HMG-CoA 還原酶的表達及其活性,刺激膽固醇的合成。同時肝臟負責膽固醇酯化的酶——膽固醇脂醯轉移酶-2 活性也增加。
除此之外,部分血漿蛋白,如卵磷脂-膽固醇醯基轉移酶(LCAT),從尿液中丟失,也會導致高膽固醇血症。
這是因為 LCAT 和膽固醇酯化有關,尿液丟失 LCAT 能降低肝外多餘膽固醇的攝取,導致肝臟對膽固醇的清除下降。這個主要影響高密度脂蛋白(HDL)。
這些變化的確切機制以及和蛋白尿之間的分子關係尚未完全清楚。
2. 高甘油三酯血症
高甘油三酯血症的形成主要是甘油三酯的清除機制受損所致。血液中富含甘油三酯的主要是極低密度脂蛋白(VLDL)和乳糜微粒(CE),其中 CE 主要轉運外源性甘油三酯及膽固醇,VLDL 主要負責轉運內源性甘油三酯。
血液中唾液酸化的 Angptl4 絕大多數是由骨骼肌、脂肪組織以及心臟分泌的,這些唾液酸化的 Angptl4 通過和腎小球內皮細胞結合,發揮降蛋白尿的作用。
但同時,這些血液中的 Angptl4 也會抑製脂蛋白脂肪酶(LPL)的活性,導致高甘油三酯血症。
這裡要提一下 LPL,它是甘油三酯代謝的限速酶,LPL 由脂肪細胞等肝外實質細胞分泌入血後,藉助硫酸肝素等葡糖胺聚糖結合在毛細血管內皮上發揮作用。LPL 可以水解血液中的 CE 和 VLDL,生成甘油、脂肪酸。LPL 的單聚體沒有活性,只有二聚體的 LPL 才能發揮分解甘油三酯的作用。
血液中的 Angptl4 會使 LPL 從有活性的二聚體形式轉變為無活性的單聚體形式,這樣甘油三酯就無法分解為遊離脂肪酸(FFA),導致高甘油三酯血症。
這就是降蛋白同時帶來的「副作用」。不管是二聚體還是單聚體形式的 LPL,在腎病綜合征時都會從尿液中丟失。
蛋白尿和高甘油三酯血症通過 2 個負反饋環路(局部反饋環和系統反饋環)聯繫在了一起,下文會詳細闡述。
低白蛋白血症
腎病綜合征的低蛋白血症通常以血白蛋白 < 30 g/L 來界定,嚴格來講低蛋白血症和低白蛋白血症是 2 個不完全一樣的概念,但臨床上一般沒有特意加以區分,主要是因為腎病綜合征時的蛋白尿以白蛋白為主,血液中降低的蛋白也大多是白蛋白。
腎病綜合征低白蛋白血症的原因有:
①蛋白尿時白蛋白通過尿液丟失;
②肝臟代償合成能力下降;
③可能還和白蛋白的分解代謝增加及分布異常有關。
低白蛋白血症的發病機制中最讓人無法理解的謎團是:腎病綜合征時肝臟代償合成的白蛋白居然不足以補充經尿液丟失的白蛋白。
要知道正常肝臟每天合成的白蛋白可是有 12-14 g/天之多,在機體有需要時,這個合成能力還可以增加 3 倍。
每天合成這麼多白蛋白,而尿液中丟失的蛋白明顯沒有這麼多,按理說血液中的白蛋白不應該低啊?但似乎合成還跟不上丟失,否則也不會有低蛋白血症了。
那麼還有一部分白蛋白哪裡去了?
我們知道腎小管可以重吸收並分解一部分,腎病綜合征時可達到約10 g/d。
低蛋白血症會給腎病綜合征患者帶來一系列的變化,我們經常關注的包括膠體滲透壓下降、內分泌代謝的異常、高凝、易感染等。但現在發現,結合FFA的白蛋白變化也同樣重要。
血漿 FFAs 通過 6 個高親和力位點以及一些低親和力位點與白蛋白非共價結合,這種結合的產物可以分為兩類:一類為高FFA-白蛋白,一類為低 FFA-白蛋白。
就是說,結合於白蛋白上的 FFA 並不是一個固定值(打個比方可以是 6 個 FFA 結合一個白蛋白,也可以是 3 個 FFA 結合一個白蛋白)。
在腎病綜合征時,大量白蛋白從尿液丟失,按理說上述兩類結合了不同數目 FFA 的白蛋白應該機會均等從尿液中排出,可是事實卻非如此,丟失的白蛋白主要是低FFA-白蛋白,至於為什麼會這樣,目前原因不明。
如此「偏心」會導致一個什麼後果呢,就是血液中高 FFA-白蛋白的含量變相增加了。這部分低 FFA-白蛋白的丟失,伴隨低白蛋白血症的發展,導致了血液中 FFA/白蛋白的比率升高。
機體會對這種情況進行「糾正」:骨骼肌、心臟以及脂肪組織攝取 FFA 增加(可以降低 FFA),分泌 Angptl4 增加(可以減少蛋白尿)。
這是高甘油三酯血症最主要的原因,也是機體的部分臟器(骨骼肌、心臟以及脂肪組織)通過分泌 Angptl4 入血來降低蛋白尿這樣一個自身調節機制。
脂質尿
脂質尿一般認為是繼發於高脂血症。HDL 因為體積相對較小,容易從腎小球濾過,因此大多數的脂質尿都是含 HDL 為主。
一般存在於卵脂體(富含脂肪的腎小管上皮脫落細胞)、脂肪管型、遊離的脂肪球等。在偏振光下,含有大量膽固醇酯成分的可以表現為典型的馬爾他十字。
1. 蛋白尿和其他臨床表現之間的分子聯繫
在我們的印象中,作為腎病綜合征始動因素的蛋白尿,和水腫等其他臨床表現之間在分子層面上似乎沒有太多聯繫。隨著研究的深入,蛋白尿和這些表現之間的分子聯繫也逐漸呈現在我們面前。
目前僅僅確定的是蛋白尿和高甘油三酯血症之間的關係。蛋白尿和高甘油三酯血症的這種聯繫主要受 FFA-白蛋白的影響。
FFA是骨骼肌和心臟主要的能量提供者,以甘油三酯的形式儲存於脂肪組織。正常情況下,這些器官攝取的 FFA 來源於下列 3 種方式:
①LPL 介導血液中的甘油三酯水解,釋放 FFA;
②來源於食物、與白蛋白結合的 FFA(中鏈 FFA);
③禁食狀態下儲存於脂肪組織中的甘油三酯脂解。這些器官同樣高表達 LPL、Angptl4、過氧化物酶體增殖物激活受體(PPAR)家族成員(可以根據 FFA 攝取情況調節 Angptl4 的表達)。
腎病綜合征時,低 FFA-白蛋白從尿液中丟失,導致體內高 FFA-白蛋白瀦留,影響了 FFA-白蛋白的攝取平衡,更多高 FFA-白蛋白被機體吸收利用。
這些高 FFA-白蛋白攝取增加,會誘導局部的 Angptl4 表達上調,使得同組織的 LPL 失活,這樣甘油三酯的分解就會減少,瀦留體內引起高甘油三酯血症,且釋放的 FFA 也會相應的降低。
為什麼 FFA-白蛋白攝取增加會誘導 Angptl4 表達增加?目前考慮可能是通過 PPARs 途徑實現的。
不同來源的 FFA 通過這種機制保持平衡,這也是局部負反饋調節的結果。
而且,這種局部負反饋從屬於更大範圍內的系統性負反饋環路,共同發揮降蛋白尿的作用。
骨骼肌、心臟以及脂肪組織釋放的 Angptl4 是通過和腎小球內皮細胞上的 αⅤβ5 整合素結合,從而發揮降低蛋白尿作用的。
各種原因導致的腎病綜合征患者體內血漿 Angptl4 水準都是升高的。在糖尿病大鼠模型給予小劑量人重組 Angptl4,發現其主要參與了系統反饋,而不是局部反饋,原因是系統反饋環的閾值較低。
通過限制 Angptl4 的上調程度,局部的反饋環路似乎可以降低系統反饋的效果。
總而言之,腎病綜合征患者 Angptl4 降低蛋白尿及升高甘油三酯的作用依賴於外周器官(脂肪組織、心臟、骨骼肌)對 FFA-白蛋白的攝取增加,間接依賴於高 FFA-白蛋白不成比例的瀦留。
2. 腎病範圍蛋白尿閾值的分子基礎
在蛋白尿沒有超過腎病範圍的閾值的時候,很少表現為浮腫、低蛋白血症以及水腫、脂質尿等。
在成人,我們定義這個蛋白尿的閾值為 3.5 g/d,但是這個閾值在不同的患者中具有較大的可變性,即使在同一個患者身上這幾種表現也各不相同。這個蛋白尿閾值的分子基礎到現在都沒有搞清楚。
目前還只能以高甘油三酯血症的形成機制作為媒介來解釋這個腎病範圍蛋白尿閾值。
如前所述,高甘油三酯血症時,血液中高 FFA-白蛋白瀦留,FFA/白蛋白比例增高,增高到一定程度(即「閾值」)後就誘導了部分臟器(心臟、骨骼肌及脂肪組織)Angptl4 的表達增加。
動物實驗研究揭示,在少量蛋白尿時,血漿 FFA/白蛋白比值、血漿 Angptl4含量、外周器官 Angptl4 及 PPAR mRNA 的表達和無蛋白尿的對照組類似。但是在嚴重蛋白尿的時候,這些指標都會有明顯升高。
因此,從高甘油三脂血症的角度看的話,腎病範圍蛋白尿是 FFA/白蛋白比值升高的一個後續效應。
3. 在腎病綜合征研究基礎上發展出來的治療手段
Angptl4 在腎病綜合征中發揮著如此重要的核心作用,這也使腎病綜合征的治療出現新的變化:Angptl4 可以直接作為一種藥物,也可以作為藥物作用的一個靶點。
Angptl4 是一個「兩面手」:
①同樣的 Angptl4,如果被分泌到不同部位,也會發揮不同的生物學作用。比如在細胞外,Angptl4 會抑製脂質水解,但是在細胞內,Angptl4 卻又促進脂質水解;
②Angptl4 是否唾液酸化也和其作用密切相關。如低唾液酸化的 Angptl4 可致蛋白尿,而唾液酸化的 Angptl4 則具有明顯降蛋白尿作用。
既然血液中唾液酸化 Angptl4 具有降蛋白尿作用,那麼可以想像,各種能夠增加血液中唾液酸化 Angptl4 的手段都可以用來降低蛋白尿,比如注射人重組 Angptl4、使用 PPAR激動劑/糖皮質激素/FFA 補充劑/β 腎上腺素激動劑促進自身心臟/骨骼肌/脂肪組織分泌 Angptl4,這些方法可以通過系統負反饋環路發揮降蛋白尿作用。
但是我們也要看到,這些措施並不是十全十美。
首先,上述這些藥物都具有一定的不良反應(多少人對糖皮質激素望而生畏?)。
其次,這些藥物可以通過局部負反饋環路加重高甘油三酯血症。
再者,這些藥物抑製了心臟、骨骼肌等臟器對FFA的攝取,更易發生臟器損傷(損傷閾值下降)。
有沒有辦法使得 Angptl4 既發揮其卓越的降蛋白尿作用,又減少或避免其上述不良反應?
人類的智慧是無窮的,通過基因技術已經實現了這個目的。
基因突變的人重組 Angptl4 在 FSGS 及糖尿病腎病的動物模型中具有非常顯著的降蛋白尿作用,且不影響血甘油三酯水準。
這主要是 40 或 39 位氨基酸發生突變(Angptl4 抑製 LPL 主要依靠接近 Angptl4 氨基末端的 12 個高度保守的氨基酸序列,處氨基酸突變會消除 Angptl4 對 LPL 的抑製效應),突變後的 Angptl4 對 LPL 的影響非常小,這樣就避開了局部反饋環路的副作用:加重高甘油三酯血症。
N-乙醯-D-甘露糖胺(ManNAc)是唾液酸的前體,可被足細胞吸收及儲存,其可使低唾液酸化的 Angptl4 轉變為唾液酸化的 Angptl4,從而顯著降低蛋白尿。小劑量 ManNAc 還可以用於預防 MCD 複發及糖尿病腎病的維持治療。
對於不管什麼原因引起的蛋白尿或腎病綜合征,這都是一個非常有前景的全新治療手段。
目前正在進行基因突變的人重組 Angptl4 長期給葯研究,如果發現其對改善 CKD 預後也有作用的話,那麼這將是蛋白尿治療領域的一個重要里程碑。
現在再回頭看看前面的問題,為什麼 Angptl4 一會引起蛋白尿,一會又降蛋白尿?目前主要考慮 2 點:
①唾液酸化程度不同。
②結合部位不同。
足細胞分泌的 Angptl4 唾液酸化程度低,與 GBM 上的一些蛋白(如帶負電荷的硫酸乙醯肝素蛋白多糖)相互作用,並且 Angptl4 會從足細胞向內皮細胞移動並沉積於 GBM,引起電荷屏障的消退,蛋白信號通路改變,最終導致蛋白尿。而腎外臟器(心臟/骨骼肌/脂肪組織)分泌的 Angptl4 唾液酸化程度高,主要和腎小球內皮細胞結合,並不沉積於 GBM,因此主要發揮降蛋白尿作用。