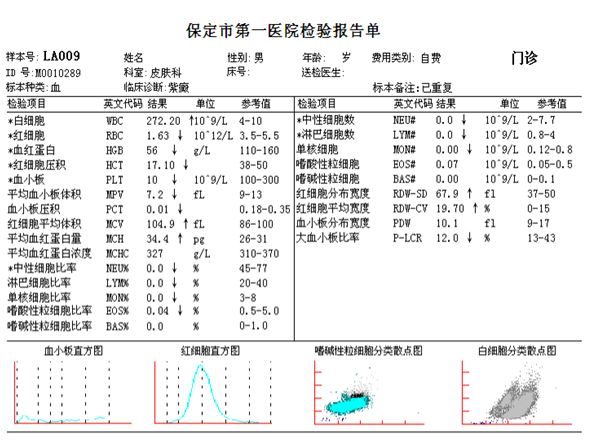
人類與慢性粒細胞白血病(CML)作鬥爭,已經有半個多世紀的歷史。電影《我不是葯神》中的「救命葯」原型格列衛(Gleevec,imatinib)就是人類在慢性白血病的治療上取得的巨大成功,被譽為是人類抗癌史上的一大突破。
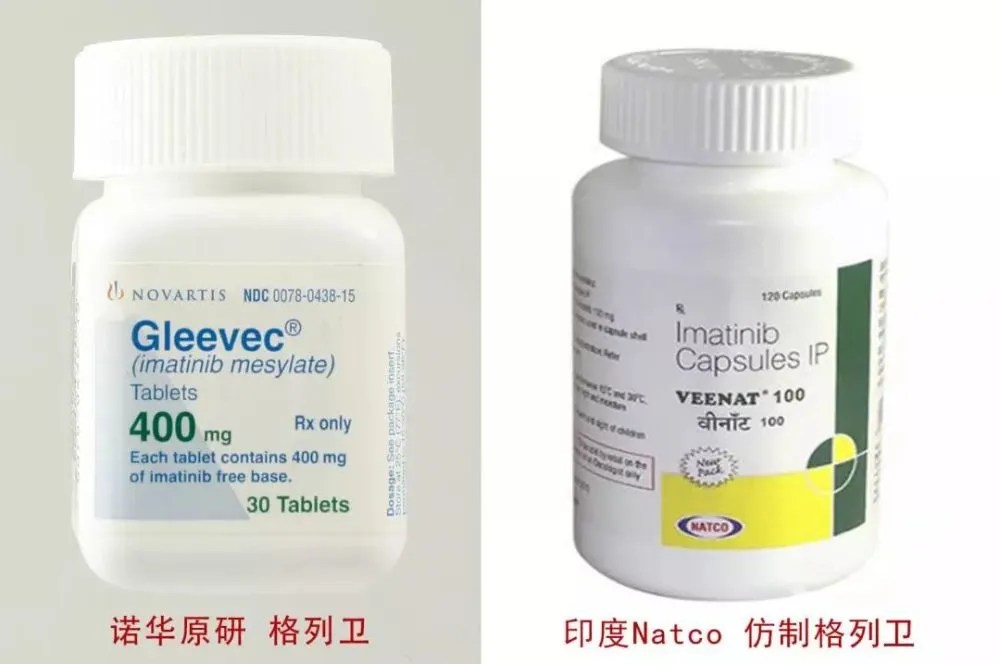
格列衛的原研與仿製
當然,今天小編不去談論電影中有些沉重的話題,我們換個話題,用輕鬆有趣的方式講講格列衛這個完全可以用傳奇來形容的研發歷史。
值得強調的是,在格列衛研發歷程中,直接或間接造就了兩項「世界第一」,5位美國科學院院士,5位Lasker臨床醫學研究獎得主(美國的諾貝爾獎)以及1位美國國家自然科學獎得主。
靶點的發現
上世紀五六十年代,主流學術界普遍認為「病毒是引起腫瘤的主要原因」。而這時賓西法尼亞大學腫瘤研究所的Nowell和Hungerford正在做一項 「離經叛道」的事情,他們正試圖在腫瘤細胞中尋找遺傳物質的改變。

Peter Nowell和David Hungerford
1956年, Nowell在研究CML細胞(慢性髓性白血病,縮寫CML)過程中發現腫瘤細胞染色體數目多於正常組織,但由於他本人非遺傳學科班出生,於是他找到了另一位研究染色體的同事Hungerford來共同研究這一現象。
1960年,他們證實在CML腫瘤細胞記憶體在一條小染色體,而為了紀念他們工作所在的城市,把這條小染色體命名為費城染色體,發表在《Science》上。

Nowell和Hungerford發表的論文
當時他們認為費城染色體為一條額外的小染色體,後來證實其並非額外的染色體。實際上直到他們發表論文3年後,人類的染色體準確數目才被確定為46條,所以他們的實驗結果也不能算是真正的錯誤。該篇論文也是世界上首次報導腫瘤與染色體變異存在關係的文章。2001年該論文還被Nature評為1889-2001年的裡程碑式論文之一。
他們的發現得到了多數人的認可,但其他科學家還是認為費城染色體只是腫瘤導致的結果而不是引起腫瘤的原因。由於費城染色體的本質不清,導致在相當長的一段時間內,費城染色體的研究裹足不前。
直到13年後,芝加哥大學的Rowley等利用喹吖因熒光以及GIEMSA染色技術發現22號染色體的缺失的長度剛好等於9號染色體多出來的長度,於是她認為費城染色體是22號染色體長臂一部分與9號染色體長臂一分部易位的結果。

Janet Rowley,芝加哥大學

22號與9號染色體易位
人們雖然明白了費城染色體為染色體易位所致,但尚不清楚其具體功能,仍然懷疑其是不是直接導致CML的原因。
直到上世紀80年代,隨著癌基因研究的興起,紐西蘭科學家Annelies等發現人與小鼠白血病病毒的一段同源基因序列(C-ABL)從9號染色體易位到了22號染色體長臂上,這一結論表明C-ABL的易位導致了CML。而後的研究表明費城染色體為9號染色體長臂(9q34)上的原癌基因ABL和22號染色體(22q11)上的BCR(染色體易斷裂區)基因重新組合成融合基因後,使酪氨酸激酶活性持續升高,從而導致了CML。

從1960年,Nowell發現費城染色體,到1973年Rowley明確費城染色體為染色體易位所致,最後到1982年Annelies發現癌基因C-ABL易位後與BCR融合使酪氨酸激酶持續激活,最終導致了CML的發生,共經歷了22年。這一曲折的過程中,Nowell首次發現腫瘤與染色體變異直接相關,Rowley首次發現染色體易位現象。

這樣的成果,讓Nowell與Rowley蜚聲國際學術界。1976年、1984年Nowell和Rowley分別被推選為美國科學院院士。1998年,他們獲得了享有美國諾貝爾獎之稱的Lasker 臨床醫學研究獎,且Rowley在同一年被美國總統授予國家科學獎,2009年被授予總統自由勳章。

Rowley被授予總統自由勳章
至此,費城染色體導致CML的作用機制已經闡明,而有兩位兩位極富遠見的年輕人,有著更大的夢想,那就是針對費城染色體融合基因BCR-ABL設計靶向藥物,從而特異性的殺滅腫瘤細胞。
曲折的研發歷程
上文說到,有兩位兩位極富遠見的年輕人,針對費城染色體融合基因BCR-ABL設計靶向藥物,從而特異性的殺滅癌細胞。今天就來說說這兩個年輕人殺滅癌細胞的故事。
1993年,年僅38歲的布萊恩·德魯克(Brian Druker)(布哥。這可是故事男主角哦~白血病朋友們,可把他記住嘍!千萬別讓他跑了啊!)來到了位於波特蘭的俄勒岡衛生科學大學(OHSU)進行科學研究。

布萊恩·德魯克(Brian Druker)
在此之前,布哥已經發現,所有慢性粒細胞白血病患者的白血球中都存在變異酶。這種酶本身是被稱為BCR-ABL的畸形基因產物,它在單一髓樣乾細胞分裂期間形成,進而被輸送至無數子代細胞中。也就是說,這種變異酶能夠產生費城染色體。

再者,BCR-ABL酶是一種正常酶類的「邪惡孿生兄弟」。正常酶能夠幫助控制白血球的產生。就如同開關被卡在了「開」的位置上,這種突變刺激了白血球的野蠻增殖,最後導致產生白血病。
科學家們便開始尋找或發明,能夠阻斷BCR-ABL酶發揮作用的化合物。布哥和他在波士頓的同事,利用專門設計的抗體,開發出了一種測定BCR-ABL酶活性的新方法。這種方法堪稱是評估慢性粒細胞白血病潛在療法的無價工具。
布哥必須同其他研究中心的競爭者展開競爭,率先找到這樣一種藥物——它可以使關鍵酶失活來抑製癌症,以及讓剩下的健康組織得以倖存下來。
傳統意義上的癌症治療是通過強力藥物對機體事實地毯式轟炸,健康細胞和癌細胞一起殺滅——即醫生口中所謂的「細胞毒藥物治療」(現在的系統性化療也是這個原理)。
而另一類靶向療法則會針對性地打擊癌症,且不會產生較強的附帶損傷。正是在這種概念的驅使下,布哥經常會在實驗室中工作到深夜十一點。
剛來到俄勒岡時,布哥就給自己定下了目標:一定要同一家製藥公司合作開發治療慢性粒細胞白血病的藥物,並使之進入臨床。
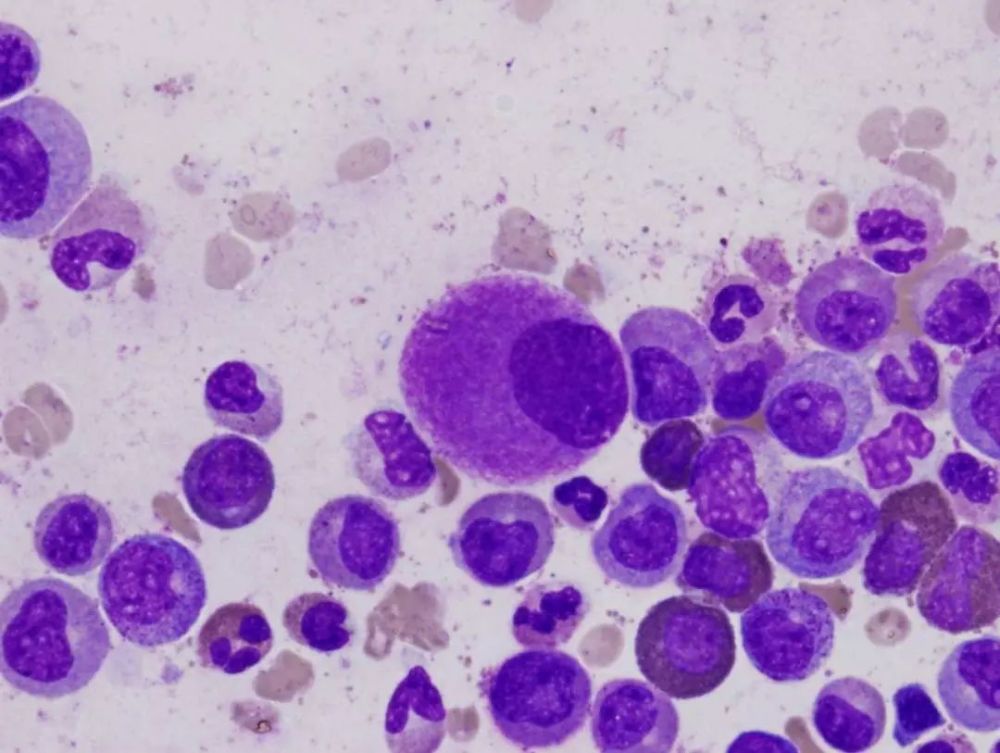
慢性粒細胞性白血病
瑞士製藥公司Ciba-Geigy(1996年該公司與Sandoz合併成為諾華公司)的生物化學家尼克·萊登(Nick Lydon)(就叫萊哥吧)是德魯克的老相識。尼克打電話給德魯克,告訴德魯克,他們公司有德魯克想找的東西。
這種藥物被稱之為STI571(格列衛在研發期間的名稱)。雖然它是諾華公司的化學家在尋找一種新型抗炎症藥物時偶然合成出來的。但通過體外實驗,研究者發現 STI571能夠抑製酶的活性。不過,他們並不確定該如何利用這種化合物。

1993 年8月,布哥收到了來自瑞士的第一批液態STI571樣品和其他候選化合物。利用自己輔助開發出的酶檢測技術,布哥證實了STI571能夠對BCR-ABL酶起到強力抑製作用。STI571屬於酪氨酸激酶抑製劑(這個名詞可要記住哦,因為有好多腫瘤葯就是這一類的)。其他化合物也能起到類似的效果,但較為微弱。

布哥又把少量的STI57樣品倒入了套管大小的容器托盤裡。托盤中盛有從一位慢性粒細胞白血病患者體內分離出來的活體白細胞液。(傳說中的體外實驗就是這樣做滴!)布哥原本只是期望細胞的生長會變慢或停止。但結果顯然更勝一籌,細胞都死光了。而且,高劑量的STI571並沒有對健康細胞造成任何傷害。「布哥的發現很關鍵,」萊哥回憶說,公司因此同意「朝這個方向進行努力。」
在滿懷著希望的研究過程中,有很多試驗性藥物,原本在實驗室中表現出良好的作用效果,但是一到人體試驗就一蹶不振。懷疑論者指出,出現這種結果的原因在於,人體中存在數百種不同類型的酪氨酸激酶,而且,不可能某種藥物在抑製一種酶的同時,也能抑製其他多數酶的活性,進而對病人生理產生巨大影響。
就職於加州拉荷亞索爾克研究所(Salk Institute)的生物化學家托尼·亨特(Tony Hunter)(托哥),就曾在《臨床研究學報》(Journal of Clinical Investigation)上撰文指出,「有很多反對者辯稱,研究者們不可能開發出用於癌症治療的特定蛋白激酶抑製劑。」
科學理念並不像蒲公英種子那樣,飄落到貧瘠的土壤上就能生根發芽。它們需要倡導者,需要那些渴望獲得成功者的扶持。布哥堅持了下來,並做了更多的試驗。譬如在小鼠身上誘導形成慢性粒細胞白血病,並利用STI571進行治療。(傳說中的動物體內實驗)
「我每周花在工作上的時間可能有六十至八十個小時,」布哥回憶說。在少得可憐的業餘時間裡,布哥還要參加自行車競賽。這項運動不僅需要高度的傷痛忍耐力,而且對於「什麼時候突出重圍的」的比賽感也有很高的要求。「在那些日子裡,實驗室工作、思考、吃飯和睡覺就是我生活的全部。」布哥說,驅使自己如此拚命的動力,就是那些命懸一線的慢性粒細胞白血病患者。

工作中的Brian Druker
1997年,布哥克已經與來自波特蘭和瑞士的合作者共同發表了大量的相關論文。他相信化合物STI571已經做好了人體試驗的準備了。
但諾華公司不同意。原因主要有兩點,首先,以靜脈形式接受給葯的狗會在導管末端出現血凝塊。來自諾華的化學家們花費了數月時間將液態藥物轉化為了藥片。(短短幾個月時間就讓液體葯變成了固體!!!這讓曾經做過新葯研發的小編受到了10萬點暴擊傷害。)
但是,當研究者為狗注入較大劑量時,這些動物會表現出肝損傷的跡象。布哥回憶說,諾華公司的某些主管曾建議徹底拋棄這個項目。

但犬科動物出現肝損傷這件事,並沒有讓布哥退卻。畢竟,化療對機體會產生破壞性。他繞過了諾華公司,直接向美國食品與藥品管理局(FDA)進行了申報,想看看自己所積累的數據是否足夠啟動人體試驗。
布哥打電話給FDA的毒理學家說了這個問題。毒理學家說:「我的天吶,你的數據太足夠了,我們肯定會接受你的申請。」隨後,布哥向諾華公司知會了這件事。布哥說:「我背著他們乾這事,會讓自己陷入麻煩之中。」 這是因為,布哥的行為雖說並不違法,但始終不太符合規矩。
1998年6月,在獲得FDA的批準許可之後,布哥利用STI571對一位患有慢性粒細胞白血病的六十八歲俄勒岡男子進行治療。「整個過程幾乎有些突如其來,」布哥回憶說,「因為我們早在1996年11月就準備好了,但過了一年半之後才真正開始啟動。」
他僱傭了兩位傑出的腫瘤學家來協助完成臨床試驗,他們分別是休斯頓安德森癌症中心(Anderson Cancer Center)的醫學博士摩西·塔爾帕茲(Moshe Talpaz)和加州大學洛杉磯分校的查爾斯·索耶斯(Charles Sawyers)。(小編內心略微有些激動,終於是啟動臨床試驗了啊!)

在三座城市中,登記入冊的所有慢性粒細胞白血病患者,都已經接受過干擾素治療。但病情要麼未出現改善,要麼出現了複發。所有患者都不適合進行骨髓移植。
隨著STI571劑量的逐漸加大,在大約六個月的時間裡,醫生們發現,患者每立方毫米將近10萬的驚人白血球計數降至正常範圍。而針對第一期病人體內白血球的分析,也沒有再發現費城染色體存在的跡象。這表明白血病患者的病情已經從源頭得到了製止。而且,更人印象深刻的是,無論BCR-ABL基因還殘存多少,它們都停止了自我複製。
「到那時候,我們才意識到,我們創造了癌症治療史上前無古人的壯舉,」布哥說。(此處應有掌聲)

隨著相關資訊在互聯網上傳播開來,其他一些慢性粒細胞白血病患者也想加入進來。布哥催促諾華生產更多的藥物。但這家製藥公司並沒有做好準備,因為這種藥物很難製造。(能在幾個月內把液體制劑變成固體制劑的諾華,居然還有覺得困難的事情?巨鱷的世界我不懂。)
時任諾華公司首席執行官現為董事會主席的丹尼爾·魏思樂(Daniel Vasella)(叫樂樂吧!有點萌~~~~)在自己關於該藥物的著作《神奇抗癌藥丸》(Magic Cancer Bullet)一書中回憶了這段往事。
「這種藥物的生產並沒有獲得高優先權,因為它只能供應給少量慢性粒細胞白血病患者,」樂樂補充道。此外,證實它的安全性和有效性也需要很多投入。「只要有千分之一的病人出現嚴重副作用,試驗便會宣告結束,」樂樂這樣在書裡寫。

1999 年9月,布哥收到了一份來自蒙特利爾的三十三歲慢性粒細胞白血病患者的電子郵件,這位病人名叫蘇桑·麥克納馬拉(Suzan McNamara)(蘇蘇)。此前她已經接受了干擾素治療,並使得自己病情得到了將近一年的控制,但後來又複發了。她希望能加入STI571的試驗。
布哥第二天就給蘇蘇打了電話。告訴她說,還需要幾個月時間她才能參與研究——諾華公司還沒有承諾會生產出更多的STI571來。但是,布哥補充說,如果公司能夠從病人那裡得到最直接的反饋,他們也許會加快進度。
蘇蘇和一位朋友創建了一個網頁形式的請願書,要求諾華公司更大量地生產STI571。結果,數千名慢性粒細胞白血病患者簽上了自己的名字。最後,蘇蘇把請願書寄給了樂樂,在附信中她說,「我們越來越擔憂地認為,試驗規模的擴張速度與利用實驗數據得出證據的速度一樣快,但藥物的供應卻跟不上。」
「這封信簡直讓人無法迴避,」樂樂看完信後如是表示。於是,諾華公司增加了STI571的產量。(看看別人家的臨床試驗入組。小編的眾多做CRA的小夥伴們不要有壓力哦~~~~~另外,還想感嘆一句:巨鱷的傲嬌,你不懂!)
對外公告早期臨床結果的榮譽落到了布哥頭上。1999年12月3日,在新奧爾良,布哥向濟濟一堂的血液學家宣布,臨床試驗中的所有31名病人都對STI571產生了積極反應,其中30位病人的白血球計數在一個月內降至正常水準。
而藥物產生的副作用,如胃部不適和肌肉痙攣,用腫瘤學家的術語來說為「輕度至中度」。布哥表示,現在自己已經不記得這些專家們站起來鼓了多長時間的掌。(布哥的含蓄式炫耀)

Harold Varmus
這些發現等同於「一位分子腫瘤學家畢生追求的夢想終於成真了,」 現為美國國家癌症研究所(National Cancer Institute)所長的哈羅德·瓦莫斯(Harold Varmus)(小哈)在當時這樣寫道,他的研究工作曾為STI571的成功奠定了一些基礎,他本人也因此被授予了諾貝爾獎。
在2009年出版的一本名為《科學的藝術性和政治性》(The Art and Politics of Science)的書中,小哈回憶說,STI571是「迄今為止,展現癌症研究最基本問題的解決,會對癌症病人帶來巨大益處的最好證據。」
CNN、紐約時報、「早安美國(Good Morning America)」節目以及美聯社都對這種突破性的抗癌藥物進行了報導。
2001年冬末,布哥和他的協作者們已經積累了大量關於STI571的臨床數據:約95%的病人其白血球恢復到正常水準,有60%病人的費城染色體未檢出。
諾華公司將上述結果和新葯申請報告遞交給了FDA,結果在兩個半月之內就獲得了批準——這是迄今為止FDA歷史上速度最快的一次藥物審核。也是為數不多的僅通過了I期臨床,就以「綠色通道」形式直接獲批的臨床一線新葯。

2001年5月,美國政府宣布這種新葯——諾華公司在北美市場定名為格列衛(Gleevec),在歐洲定名為Glivec——將會用於治療慢性粒細胞白血病患者。
這是一個決定性的時刻。先前的、基於試錯測試、偶獲成功卻總是令病人生不如死的癌症治療史,都會被專家們視為是「前格列衛時代」。在此之後的「後格列衛時代」,人類迎來了癌症的靶向治療。
5月10日在華盛頓召開的新聞發布會上,美國衛生和公眾服務部(Health and Human Services)的部長湯米·湯普森(Tommy Thompson)稱讚格列衛的發明是癌症治療領域的一次「突破性進展」,它代表了抗癌藥物的「未來發展潮流」。
而美國癌症研究所的所長理查德·克勞斯納(Richard Klausner)則將其描述為展現「癌症治療美好未來的一幅圖景」。

在格列衛的孕育過程中,直接或間接造就了兩項「世界第一」(首次發現腫瘤細胞中的染色體變異、首次發現染色體易位現象),5位美國科學院院士,5位Lasker臨床醫學研究獎得主(美國的諾貝爾獎)以及1位美國國家自然科學獎得主(類似我國的最高科學技術獎)。
而格列衛本身凝聚著多個國家幾代腫瘤學家、藥學家、臨床醫學家的共同智慧,更是基礎研究所、藥物研發公司、臨床醫療中心密切合作造就的轉化醫學的世紀經典。
至此,格列衛上市前的研究已完全結束。而一個藥品並不是只要上市之後就完事大吉了的。上市後還有IV期臨床試驗,關於適應症方面的臨床試驗。以及根據臨床試驗所反饋的結果,進行相應的製藥工藝方面技術改造。關於這方面的內容,將在下一回講解。
臨床數據
在格列衛出現之前,醫學界對於CML的標準治療方法是α干擾素+阿糖胞苷。在格列衛上市之初,就有科學家將這兩種治療方法進行長期結果比較,即干擾素和格列衛國際隨機研究(IRIS)。對患者訪年限的中位數是10.9年(隨訪就是,患者到接受治療的醫院去複查,或者醫院聯繫患者,讓大夫持續了解患者病情變化的過程。)。研究結果顯示,在存活率方面,格列衛能夠顯著提高。
像這種跨界研究,總存活率的直接比較是難以偽造的。研究者估算,接受格列衛作為他們起始治療的患者,10年存活率達到了83.5%。這樣的數據比得上其他基於格列衛的試驗,例如,CML-IV研究報導的10年總存活率為84%。與之相對的是,IRIS試驗中另外那50%的患者,被隨機安排在對照組。(對照組,可以理解物理中的參照物,就是結果判定標準。如果試驗組的結果優於對照組,那麼就是積極結果。如果試驗組的結果劣於對照組,那麼就是消極結果。)不幸的是,他們在五六年間紛紛離世了。

這些最新結果更加證實了早前的一些發現,比如,使用格列衛作為初始治療能夠顯著提高存活率。同時,也發現了一些不太嚴重的與藥品相關的不良事件或是毒性反應。在553名接受格列衛作為初始治療的患者中,有6.9%由於不良事件結束了治療。
在格列衛組中共報導過39起(7.1%)全因(就是可能是由任何原因引起的)嚴重心臟不良事件,及62名患者(11.3%)報導出繼發性瘤,包括良性的和惡性的。有51位患者發生與格列衛有關的不良事件。最常見的是腹痛,共有4位患者發生該狀況。
該分析也展示了,有48.3%的患者被隨機安排,接受格列衛作為起始治療。他們完成了全部的治療過程,其中有82.8%的患者獲得完全細胞遺傳響應,也就是前面幾篇文章中寫的「病人體內白血球的分析也沒有再發現費城染色體存在的跡象」。
在IRIS長達10年的隨訪過程中,接受格列衛治療患者的長期結果已經被確認,也在早期發現的基礎上有了更進一步的拓展。研究者在近幾年的隨訪中,並沒有發現新的關於安全性的信號,也沒有發現與藥物有關的嚴重不良事件。那些可以接受評估的患者,他們在分子水準和細胞遺傳的響應率都相當高。
在獲得治療的主要分子響應的患者中,一項關於CML-相關性死亡的分析,證實了10年存活率為97.8%。而沒有主要分子響應的患者,他們的存活率為89.4%。這樣的趨勢,與患者治療18個月時的十分相似。有經驗的醫生,可以根據18個月的治療結果來判斷10年存活率。
未來發展
格列衛的問世,讓人們開始醒悟過來,原來癌症從來就不是必須被一舉消滅的致命入侵者,它是一種可以被控制的慢性病,就如同糖尿病一樣。由於現在CML患者可能繼續生存數十年,那麼,密切監控和管理與年齡相關的健康問題,以及其他慢性疾病導致的其他身體狀況,也就尤為重要了。
然而,大多數患者在服用格列衛很長一段時間之後,會產生耐藥性。所幸的是,醫學家和製藥公司已經開發出兩種治療慢性粒細胞白血病的新型藥物:達沙替尼(Sprycel)和尼洛替尼(Tasigna),每一種都能夠通過不同的方式讓BCR-ABL酶失活,並為格列衛的一種抗性提供補償措施。
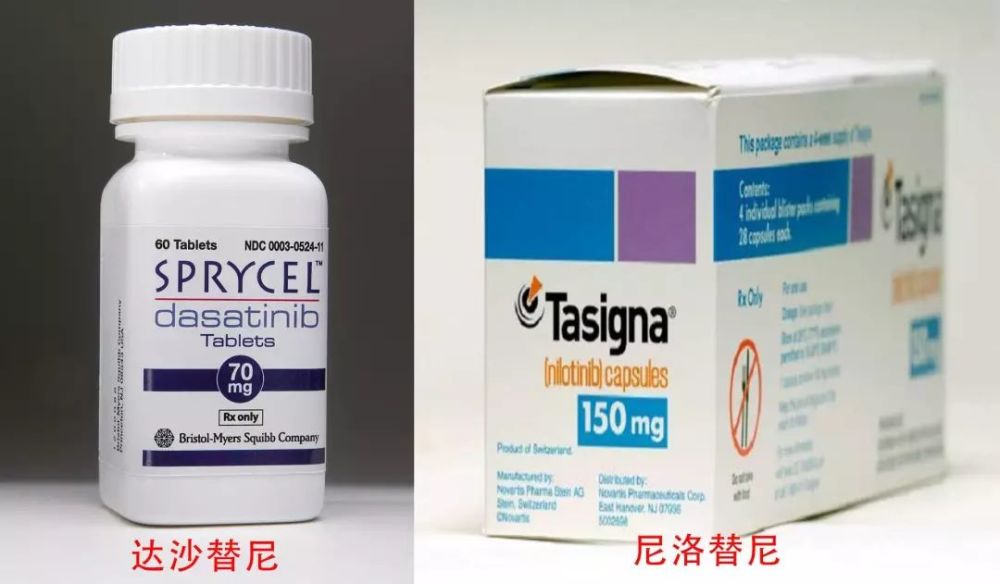
關於格列衛耐葯的機制,也已經被科學家們找到。BCR-ABL基因的變異導致了耐葯。在未來,臨床醫生需要對特定個體的腫瘤,進行徹底的分子缺陷分析,並為他們匹配毒性低且反應持久的特殊高效治療方案。以解決其耐藥性的問題。
雖然,我們關於格列衛的傳記寫完了。但格列衛的傳奇並沒有完結。它將繼續他的光輝之路。
本文部分內容整理改編自網路。
文章參考:
1.《「格列衛一個轉化醫學的世紀典範」的前世今生說開去》 作者:劉喬飛
2.《格列衛傳奇作者》作者:Jerry Pharmcube
3.Nowell P C, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science, 1960, 132:1488–1501.
4.Rowley JD. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature, 1973, 243:290–293
5. de Klein A, van Kessel AG, Grosveld G et al. A cellular oncogene is translocated to the Philadelphia chromosome in chronic myelocytic leukaemia. Nature, 1982, 300: 765–767.
6.Groffen J, Stephenson JR, Heisterkamp N, et al. Philadelphia chromosomal breakpoints are clustered within a limited region, bcr, on chromosome 22 . Cell, 1984, 36(1):93-99.
春風健康 海外就醫購葯服務機構
為患者提供國際藥品DTP、國際會診和臨床試驗招募等服務。架起患者與希望的橋樑。專註C肝、癌症等重症的內容產生和運營,傳遞抗癌和疾病康復的基本知識和最新資訊,助力患者正規治療的每一步。關注微信公眾號 「 春風健康」,獲取更多腫瘤資訊。