替諾福韋艾拉酚胺,即富馬酸丙酚替諾福韋(TAF)是一種靶向肝髒的低耐藥、低劑量(約為TDF十分一)的更為安全的核苷酸類似物(NAs)之一。新藥研發進入上市後,還有第4期最大範本的科學研究,目的是為了監管藥品上市以後的安全性和療效。

B肝新藥四期臨床試驗,評估替諾福韋艾拉酚胺,普遍有效性研究
一項更新於2019年11月26日,題目:富馬酸丙酚替諾福韋(TAF)普遍有效性的現實意義研究,是由同濟醫院主辦(Tongji Hospital),合作者是吉利德科學共同完成TAF有效性研究。它被發表於美國臨床試驗數據庫,屬於多中心、前瞻性、現實意義的研究,主要針對男性、非懷孕、非哺乳期的e抗原陽性或陰性的成年女性慢性B肝患者(18歲以上),並且這些試驗對象需符合單純為B肝病毒感染者,接受過治療或未接受任何治療者。
這類人群將接受TAF單獨使用或與其他抗病毒藥物聯用,試驗為期36個月,研究人員會持續評估TAF對CHB的安全性和抗病毒作用。開始時間2019年1月25日,初步完成時間2023年5月1日,預估完成時間2023年9月1日,預期納入500名受試者(見下圖)。富馬酸丙酚替諾福韋是NAs的新型靶向肝髒藥物,在3期臨床試驗數據說明,TAF相比TDF的安全性有了較為顯著提升,但即便上市仍需監測TAF。

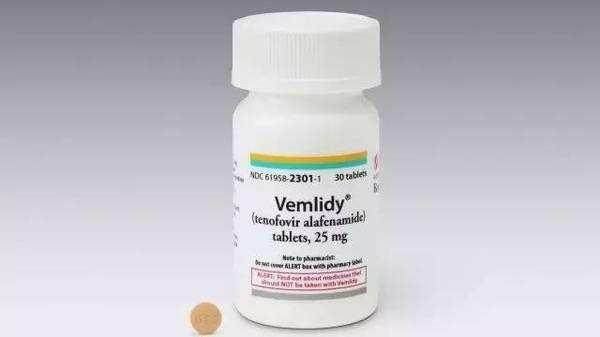
簡單的講,這是一項在我國主導完成,吉利德科學協同合作的一項TAF第4期臨床試驗。可以看到,本試驗納入標準較寬,主要是針對單純B肝病毒感染者,無論是否接受過治療均可以參與使用TAF研究,主要為單用TAF或TAF聯用其他抗病毒藥物。TAF,其他名稱為Vemlidy®,劑量為25mg,每天1次,可以隨餐口服,療程36個月;受試者單用TAF或聯合用藥治療。
這項研究主要考察結果指標:36個月治療後,血清HBV-DNA小於20IU/mL,將根據羅氏分子診斷公司的COBAS-TaqMan HBV測試測量血清HBV-DNA小於20 IU/mL的受試者比例;次要結果指標:12個月治療後,血清HBV-DNA小於20IU/mL的受試者比例、HBV-DNA小於300IU/mL的比例;24個月治療後,血清HBV-DNA小於20IU/mL的受試者比例、HBV-DNA小於300IU/mL的比例。

36個月治療後,HBV-DNA小於300IU/mL的比例、B肝e抗原消失的參與者比例、e抗原發生血清學轉換的比例、丙氨酸轉氨酶(ALT)正常的參與者比例;在治療36個月後,研究人員採用Fibroscan®評估受試者的纖維化比較基線的變化、骨骼密度(BMD)比較基線的百分比變化、採用Cockcroft-Gault公式評估受試者的腎小球濾過率和基線之間的變化。
本試驗主要面向成人慢性B肝(CHB),年齡為18-65歲的成人或老年人,但不接受共同感染者參與本項研究,例如,同時為HBV-HCV感染者、HBV-HDV感染者、HBV-HIV感染者或者已經接受過TAF治療的失代償期肝病或肝細胞癌(HCC)的受試者。小番健康認為,本項研究具有較強的現實TAF循證意義,新藥上市以及臨床3期均有較好數據作為支撐,但不應忽視上市後持續跟蹤藥品新發生不良反應和療效。

小番健康結語:富馬酸丙酚替諾福韋(TAF)屬於新型核苷類似物的B肝抗病毒優選藥物,但用藥前,應由正規醫院肝病臨床醫生指導下方可以使用。同濟醫院為華中科技大學同濟醫學院同濟醫院傳染病研究所主導進行,吉利德科學合作完成本項TAF的36個月研究(可見上方英文數據庫截圖內容)。返回搜狐,查看更多
責任編輯: