本文系生物谷原創編譯,歡迎分享,轉載須授權!
美國醫藥巨頭強生(JNJ)旗下楊森製藥近日宣布已向美國食品和藥物管理局(FDA)提交了一份補充新葯申請(sNDA),申請批準口服抗凝血劑Xarelto(中文品牌名:拜瑞妥,通用名:rivaroxaban,利伐沙班)用於急性醫學疾病患者,預防靜脈血栓栓塞(VTE)。如果獲得批準,將增加至Xarelto 5個現有的VTE適應症。

據估計,在美國,每年約有800萬人因急性醫學疾病住院,這些疾病包括嚴重但常見的疾病,如心力衰竭、中風、呼吸功能不全、傳染病和炎症性疾病。醫院相關VTE是這類人群過早死亡和殘疾額主要原因,VTE風險也會延伸至門診患者(即不住院的患者)。事實上,約67%的新近住院患者在出院後一個月內發生VTE。目前的指南建議,有VTE風險的患者在醫院接受抗凝劑治療,但不建議在出院後進行常規抗凝治療。
該sNDA是基於III期臨床項目EXPLORER中2個III期研究MAGELLAN和MARINER的數據,這2個研究評估了Xarelto在急性醫學疾病患者住院期間和出院後預防VTE的療效和安全性。其中,MAGELLAN研究評估了Xarelto 10mg在急性醫學疾病患者中從住院開始直至出院後預防VTE的療效和安全性,該研究達到了2個共同主要終點:Xarelto短期使用(10±4天)非劣效於抗凝血劑依諾肝素(enoxaparin),長期使用(35±4天)優於短期使用依諾肝素及隨後的安慰劑治療。臨床相關的大出血和非大出血合併率在Xarelto治療的患者中較高。
基於MAGELLAN研究結果的基礎上,MARINER研究在類似的醫學疾病患者群體中開展,評估了Xarelto預防出院後VTE和VTE相關死亡的療效和安全性。研究結果顯示,儘管Xarelto沒有減少VTE和VTE相關死亡複合終點,但該葯卻顯著減少了癥狀性VTE,並表現出一致和有利的安全性,加強了Xarelto的積極效益風險。
儘管VTE在很大程度上是可以預防的,但對於美國800萬患有急性醫學疾病的患者來說,VTE仍然是一個重大風險。
楊森研發心血管代謝全球治療區負責人James List表示,「儘管在離開醫院後6周內具有高風險的VTE,但只有不到4%的醫學疾病患者在離開醫院後接受抗凝治療以預防VTE。我們希望讓Xarelto在這些患者仍然處於危險中的時候對這些患者有效,從住院直至家庭康復期。」
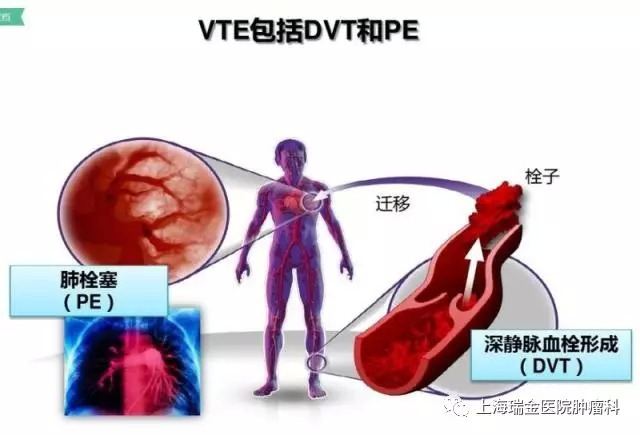
截至目前,Xarelto已批準了5個VTE適應症,包括:治療深靜脈血栓(DVT)、治療肺栓塞(PE)、降低複發性DVT和PE風險,以及在剛接受髖關節和膝蓋置換術的患者中用於DVT的初級預防。2017年10月,FDA批準了一種新的劑量方案:每日一次10mg Xarelto,用於在完成至少6個月初始治療後降低複發性VTED的持續風險。
Xarelto是全球用藥最廣泛的非維生素K拮抗劑類口服抗凝劑(NOAC),目前已獲批8個適應症,不同國家適應症有所區別。與其他NOAC相比,Xarelto能夠為廣泛的患者群體提供幫助,預防多種靜脈血栓栓塞(VTE)和動脈血栓栓塞(VAT)疾病疾病。
Xarelto由拜耳和強生合作開發,強生負責美國的銷售,拜耳負責美國以外地區的商業化銷售。截止目前,Xarelto已獲全球130多個國家批準。在2017年,Xarelto的全球銷售額達到了56.4億美元,其中美國市場銷售25億美元。全球醫藥市場調研機構EvaluatePharma今年年初發布報告預測,Xarelto在2024年的全球銷售額將達到59.15億美元,其中美國市場將達到43.02億美元。
參考資料: