今天是2019年1月3日
農曆冬月廿八
醫麥客:小分子,腫瘤免疫治療新玩家
2019年1月3日/醫麥客 eMedClub/--1891年,美國外科醫生W. Coley報導,熱滅活的細菌疫苗(Coleytoxins)可以誘導肉瘤患者的腫瘤消退,這是第一個證據表明免疫系統可以被利用於癌症的治療。隨後,儘管在免疫學和分子生物學方面取得了很大進展,但免疫學家在努力開發強大而有效的基於免疫的癌症治療方法方面受到了極大的阻礙。
在過去的十年中,腫瘤免疫治療領域取得了顯著的成功,並且顯著延長了部分患者的生存期,甚至是長期存活,其中扮演主要角色的是基於生物學的治療方式,如:
人源化單克隆抗體(mAb)
通過阻斷T細胞和NK細胞中表達的免疫抑製性受體已被證明是一種有效的癌症療法,如CTLA4抑製劑(ipilimumab/Yervoy, 百時美施貴寶[BMS])或PD-1抑製劑(nivolumab/Opvido, BMS; pembrolizumab/Keytruda, 默沙東[MSD]),被批準用於轉移性黑素瘤、肺癌和腎癌等十多種類型的腫瘤。阻斷PD-1的配體PD-L1,如PD-L1抑製劑atezolizumab/Tecentriq已被批準用於膀胱癌等適應症。
CAR-T細胞療法
去年,FDA批準了兩款CAR-T產品上市,分別是諾華的Kymriah以及吉利德/Kite的Yescarta,這是裡程碑式的事件,採用經改造的自體T細胞來治療癌症患者。經歷過2種或更多的系統治療的B細胞前體急性淋巴性白血病(ALL)、複發或難治性瀰漫性大B細胞淋巴瘤(DLBCL)和原發性縱隔大B細胞淋巴瘤(PMBCL)的患者有了新的治療選擇。
腫瘤疫苗
2010年4月29日,美國 FDA正式批準Dendreon公司的基於樹突狀細胞(DC)的Provenge用於治療無癥狀或具有輕微癥狀的轉移性去勢抵抗性(激素難治性)攝護腺癌,該藥物成為美國FDA批準的首個且唯一一個癌症治療性疫苗。
2017年1月,三胞集團與全球生物醫藥界知名企業Valeant公司在舊金山達成股權收購協定,收購後者旗下美國生物醫藥公司Dendreon100%股權,從而將成為Provenge的擁有者。
腫瘤免疫治療的時代已經到來,並將在可預見的未來在癌症治療中發揮關鍵作用。當前,人們尋找改善癌症免疫反應的新型方法的熱情仍然有增無減。
為此,正在積極尋求能夠減少腫瘤環境中的免疫抑製或增強細胞毒性淋巴細胞對腫瘤反應的小分子,這種新的治療策略可以用作單一療法或與其他癌症療法組合以增加和擴大其功效。
現有腫瘤免疫療法存在局限性
免疫檢查點抑製劑(ICI),例如:CTLA-4阻斷被認為通過啟動腫瘤反應性T細胞的初始啟動來增強腫瘤免疫,而PD-1阻斷被認為可以減輕導致腫瘤微環境中CD8+ T細胞衰竭的抑製性機制。對於PD-1和CTLA-4,ICI方法的成功表明,任一策略都可以促使腫瘤的有效免疫控制,同時提高患者的存活率。儘管取得了明顯而令人印象深刻的成功,但目前的腫瘤免疫治療手段仍然存在局限性。
基於蛋白質(Ab)的ICI方法顯示出顯著的毒性,包括在相當大比例的患者中對胃腸道和肺部的免疫攻擊。在某些情況下,這些自身免疫攻擊可能是致命的。此外,ICI僅在快速生長的「熱」腫瘤中有效,而對進展較慢的「冷」腫瘤無效(其中腫瘤中的突變頻率較低,因此腫瘤中可能存在較少的腫瘤特異性新生抗原可供T細胞識別和靶向)。
又如,CAR-T細胞經過基因改造方法來改善可以對癌細胞起反應的T細胞數量,已經在靶向CD19+血液腫瘤方面取得的巨大成功,但可能很難複製到實體瘤適應症上,其中可能缺乏可被CAR靶向同時不存在於正常組織的細胞外抗體。這對於將CAR-T細胞策略推廣到超出血液學惡性腫瘤的癌症提出了重大挑戰。
攪局者?基於小分子的腫瘤免疫療法
現階段,免疫療法在癌症治療方面要想取得進一步的進展,亟待創新方法。
與ICI和CAR-T細胞的臨床進展平行,一系列基於小分子的免疫療法從最初的發現到臨床試驗階段行進中,其中包括能夠靶向免疫抑製機制或激活先天和/或適應性免疫途徑(生物療法不起作用)的化合物。涉及對腫瘤作出免疫反應或抑製這些反應的各種類型的免疫細胞、受體和分子途徑提供了潛在分子靶點的聚寶盆。通常,這些分子靶標對應於受體或參與細胞內信號轉導的酶。
相對於生物製劑,小分子的優點包括:
口服生物利用度;
對腫瘤微環境的更大滲透性,以及穿過細胞膜進入細胞內靶標的能力;
更容易精確控制其生物利用度:避免一些與基於Ab和細胞的生物療法相關的免疫相關不良事件;
生產和管理成本較低:可以獲得更大的患者可及性,特別是在發展中國家。
小分子可在腫瘤免疫中扮演全方位角色


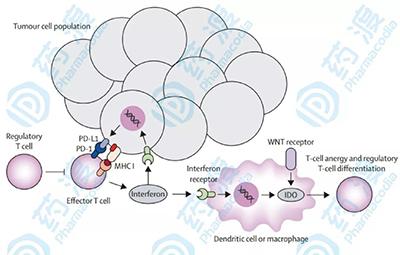
腫瘤微環境中的小分子及其靶標(圖片來源:jimmunol)


臨床前及臨床階段小分子化合物(圖片來源:jimmunol)
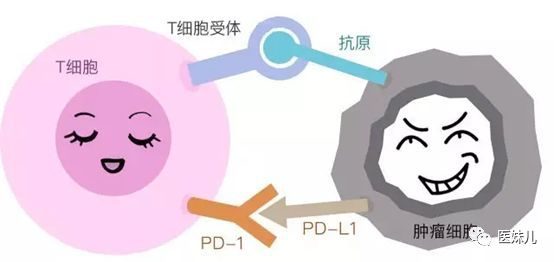
小分子,下一代ICI腫瘤細胞和免疫抑製性骨髓細胞在腫瘤微環境中可以表達PD-1,PD-L1的配體。當PD-L1與PD-1結合時,這會引起已經進入腫瘤的CD8 +細胞毒性T細胞的衰竭,損害腫瘤反應性細胞溶解性T細胞反應。
許多mAb(單克隆抗體)靶向PD-1-PD-L1軸,破壞這種相互作用,從而增加T細胞對腫瘤的反應。然而,這些療法還可以導致對正常組織(包括胃腸道、肺和甲狀腺)的免疫攻擊,因此免疫相關的不良事件發生頻率非常高,並且在某些患者中會發生嚴重的,有時甚至是致命的後果。人源化Ab治療的體內半衰期延長與這些毒性有關。
目前正在探索拮抗PD-1-PD-L1相互作用的小分子,因為可能更容易控制其生物利用度,從而減輕毒副作用。最初的方法集中在使用拮抗PD-1-PD-L1相互作用的肽或肽模擬物。隨後,進一步發展成開發更成熟的小分子,成功地拮抗PD-1-PD-L1結合。
這種分子進化的最新迭代是由BMS的科學家研發的取代的二芳基衍生物。該計劃中表現最好的兩種化合物BMS-1001和BMS-1116可以在用NFAT-熒光素酶報告基因構建體轉染的Jurkat T細胞系中完全恢復抗CD3介導的T細胞活化。
最近,生物製藥公司Curis報導了兩種小分子,它們不僅可以拮抗PD-L1結合,還可以與另一種ICI,VISTA(CA-170)或TIM-3(CA-327)結合。CA-170已進入針對晚期癌症患者的I期臨床試驗。這些化合物具有同時拮抗多種ICI受體的令人興奮的可能性,其可能更有效地抑製免疫逃逸。
小分子可有效地拮抗配體與ICI受體的結合,並且在基於細胞的分析中顯示強效活性,表明這種免疫治療策略具有極大的希望,特別是,如果能夠更好地控制其藥效學和葯動學,則可以避免與ICI mAb相關的免疫相關不良事件。這些方法還可能促使小分子ICI方法的發展,例如篩選穿透血腦屏障的小分子,使ICI能夠應用於原發性腦癌或腦轉移,而這些都不適合當前基於Ab的ICI治療。
小分子,激活先天免疫系統TLR激動劑
模式識別受體的激動劑也被用作潛在的免疫療法或佐劑,這些激動劑分為兩大類:核苷酸寡聚化結構域(NOD)樣受體(NLR)激動劑和Toll樣受體(TLR)激動劑。TLR激動劑在該領域最受關注,共有13種TLR,它們在免疫細胞譜中廣泛表達,包括DC、B細胞、巨噬細胞、NK細胞和T細胞。TLR可以促進針對腫瘤的T細胞應答,因此其激動劑正在免疫腫瘤學中被開發應用。


TLR信號通路(圖片來源:Nature Reviews丨Immunology)
最佳表徵的化合物是咪唑喹啉,例如咪喹莫特(imiquimod)及其衍生物。這些化合物用作TLR7/8激動劑。母體化合物咪喹莫特已被批準用於局部用於基底細胞癌。轉移性黑色素瘤和局限性膀胱癌的試驗也在進行中,後者獲得了積極的結果。咪喹莫特類似物瑞喹莫德(resiquimod)也被用於局部皮膚T細胞淋巴瘤,並已得到初步陽性結果。
然而,該領域的主要局限之一是與全身施用TLR7/8激動劑相關的潛在嚴重毒性,因為它們可引發可能致命的嚴重細胞因子風暴,這限制了它們的臨床實用性。為了克服這個缺點,VentiRx Pharmaceuticals開發了新的TLR7(852A)和TLR8激動劑(852A和VTX-2337)。這些分子針對全身遞送進行了優化以避免毒性,已經在患有血液惡性腫瘤和實體瘤的患者中測試了這些化合物,並觀察到緩解反應。
TLR激動劑似乎已經顯示在免疫腫瘤學中的治療前景,但Huck及其同事警告說,在某些情況下,持續的TLR誘導的免疫可以促進癌症生長,並且在某些情況下,還可以促進免疫抑製細胞的增加。因此,仍需要進一步研究以更好地了解使用何種激動劑,並且如何給葯以達到最大效果,同時避免這些負面影響。
腫瘤免疫治療新星TLR 9激動劑:助力強效癌症疫苗開發,實力挑戰PD-1抗體耐葯怪圈丨醫麥猛爆料
STING激動劑
另一種免疫刺激性小分子的分子靶標是IFN基因刺激物(STING)信號通路,其由上皮細胞、內皮細胞和免疫細胞(如DC和T細胞)表達。早在2008年,邁阿密米勒醫學院的Barber教授就發表了一篇關於STING的研究,表明其具有識別病毒和細菌感染以及啟動機體的防禦和免疫反應的作用。
STING是人固有免疫系統的組分,是先天免疫的中樞調節劑,是人體對抗諸如細菌以及病毒等外界病原體入侵的第一道防線,在人體出現感染期間能夠被激活。當受到刺激時,STING誘導I型IFN、細胞因子和T細胞募集因子的表達,並通過一系列的級聯反應,激活適應性免疫系統,活化T細胞。


STING信號通路(圖片來源:Aduro)
最近,環二核苷酸(CDN)的硫代磷酸酯衍生物已被開發為具有增加的體內穩定性的STING激動劑。幾種合成的CDN或該途徑的間接小分子調節劑正在進行臨床試驗,以作為疫苗佐劑或與ICI療法聯合,例如ADU-S100、MK-1454。
CDN的一個限制是當前版本必須直接注射到腫瘤中。尚不清楚這些強效免疫刺激劑的全身給葯是否可以安全地進行,因為許多適用於TLR激動劑的相關問題也是存在於STING激動劑。為解決這一問題,最近發現共價STING抑製劑可以減少STING激動劑誘導的炎症細胞因子。
2018年11月7日,頂級學術期刊Nature發布了一篇葛蘭素史克(GSK)的科學家共同發表的科研論文,宣布他們發現了一個全新的STING激動劑,只需靜脈給葯,使小鼠腫瘤完全消失、且療效長久維持。
2018年12月12日,Aduro Biotech聯合製藥巨頭諾華在Cell Reports發表在研STING激動劑— —ADU-S100 (MIW815)的臨床前數據,強調了優化STING激動劑治療劑量方案的重要性。該藥物是第一個進入臨床的STING通路小分子激活劑,目前主要應用在乳腺癌、頭頸癌、腎細胞癌以及黑色素瘤和淋巴瘤等適應症上。
備受諾華青睞的Aduro,會將STING打造成下一片藍海嗎? | 醫麥猛爆料
小分子,使細胞毒性淋巴細胞成為超級殺手Btk和Itk抑製劑
Tek家族激酶Bruton酪氨酸激酶(Btk)和誘導型T細胞激酶(Itk)在免疫細胞信號傳導中起著至關重要的作用。Btk對BCR信號傳導和骨髓細胞活化至關重要,而Itk在促進Th2免疫的近端TCR信號傳導中起作用。此外,使用Itk2/2小鼠的研究表明,Itk對轉錄因子IRF4介導的調節性T(Treg)細胞分化至關重要。
Btk和Itk的不可逆共價抑製劑— —依魯替尼(ibrutinib)可以損害Th2免疫,從而產生Th1偏向的T細胞區室,其有利於對某些病原體和腫瘤細胞的細胞免疫;依魯替尼還可以同時減少腫瘤環境中的Treg細胞數量,然後可能會發生肆無忌憚的抗腫瘤Th1反應。
在一項單獨的研究中,發現依魯替尼不僅可以增強體內根除表達Btk的淋巴瘤,當與PD-1/PD-L1阻斷相結合時,在缺乏Itk或Btk表達的乳腺癌和結腸癌中也有效。這些功效表明,至少當與ICI組合時,依魯替尼通過增強腫瘤免疫力而具有獨立於其化學治療效果的抗腫瘤作用。
目前正在進行多項臨床試驗,其中依魯替尼或acalabrutinib(Btk選擇性抑製劑)與Ab ICI療法聯合,相信應該很快就會公布關於Btk和/或Itk抑製劑對腫瘤免疫療法的有效性資訊。此外,目前的臨床前和臨床研究結果表明,更有效和選擇性的Itk抑製劑也可能在免疫組學中發揮重要作用。
SHIP1抑製劑
與Btk和Itk一樣,SHIP1最近也被發現作為免疫治療靶標的新用途。SHIP抑製劑的抗癌特性首先在血液淋巴瘤中得到證實,例如多發性骨髓瘤(MM)和急性髓性白血病,其中SHIP1令人驚訝地促進癌細胞的存活。
最初,很少考慮這些化合物可能促進腫瘤免疫,後來用SHIP1選擇性抑製劑3AC延長每日治療時發現解除了NK細胞,損害了MHC不匹配的骨髓移植物排斥,並且還促進了體內免疫調節性髓源性抑製細胞( MDSC)和Treg細胞的擴增,所有這些都可能導致腫瘤免疫控制受損。臨床前研究表明SHIP1選擇性化合物在免疫腫瘤學中具有治療潛力。
小分子,協助逃離免疫抑製旋渦IDO抑製劑
過去十年裡,產生N-甲醯基-犬尿氨酸(一種T細胞活化的抑製劑)的酶促途徑也已經成為大量研究的主題。這是由Van denEynde及其同事的初步觀察得出的,他們發現腫瘤細胞表達IDO,一種含有血紅素的雙加氧酶,以及它的色氨酸分解代謝途徑中的其他酶(TDO,IDO2)產生犬尿氨酸有助於腫瘤細胞逃避免疫監測。
犬尿氨酸在腫瘤微環境中具有多種免疫抑製作用,包括剝奪TCR活化所需的色氨酸效應T細胞,通過芳基烴受體(AHR)促進Treg細胞功能,並通過誘導PD-1表達來拮抗CD8效應功能。
因此,IDO抑製或色氨酸分解代謝途徑的其他組分已成為免疫腫瘤學中的大量努力的主題,其中一些有效的IDO抑製劑(例如,epacadostat)與Ab療法組合推進至III期臨床試驗。
然而,最近的臨床結果令人失望,導致在該領域活躍的製藥公司緊縮。在免疫腫瘤學中,IDO抑製劑或酶的未來發展難以預測,但鑒於主要製藥公司的廣泛認識,對該領域未來的擔憂似乎是合理的。
Survivin肽抗原與IDO抑製劑聯合突破腫瘤微環境,ESMO大會傳來卵巢癌1b / 2期治療陽性數據丨醫麥猛爆料
精氨酸酶抑製劑
精氨酸分解代謝的抑製也被視為緩解腫瘤中免疫抑製的潛在方法。這是因為免疫抑製性髓樣細胞群,如MDSC和腫瘤相關巨噬細胞,表達精氨酸酶1,這是一種將精氨酸分解成鳥氨酸和尿素的酶。精氨酸是在TCR複合體中表達 CD3ζ鏈所必需的,因此細胞外腫瘤環境中精氨酸酶1的消耗損害了腫瘤部位的T細胞效應功能。
精氨酸酶抑製劑的另一種作用機制涉及精氨酸的消耗,其可能通過iNOS觸發底物轉換,刺激活性氧和氮物質的產生,這可能促進免疫抑製。因此,對精氨酸酶1和iNOS的雙重抑製可能是優選的治療途徑。
硝基氧阿司匹林類似物NCX-4016已被證明具有這種抑製作用,並可改善體內對腫瘤的免疫應答。隨後的研究發現了更有效的化合物水楊酸鹽AT-38的鑒定,該化合物在體內也顯示出抗腫瘤活性。
到目前為止,似乎還沒有針對這類化合物的臨床開發計劃,這可能是由於對關鍵生理過程如血管功能的影響。
胞外核苷酸酶抑製劑
ATP的分解代謝也可以介導腫瘤微環境中的免疫抑製。
在腫瘤微環境中,Treg細胞表達胞外核苷酸酶(CD73,CD39),使ATP去磷酸化生成腺苷。腺苷與腫瘤中淋巴細胞上的腺苷A2A和A2B受體結合,並抑製它們介導腫瘤細胞效應功能的能力,例如細胞溶解。腺苷還可以通過與其表面上的A2A受體結合來增強Treg細胞的免疫抑製作用。已經提出,在腫瘤微環境中存在缺氧-腺苷能軸,其中缺氧誘導型轉錄因子(HIF-1a)可以激活上述幾種有助於腫瘤內免疫抑製的受體。
因此,靶向外核苷酸酶(CD39,CD73)或腺苷受體(A2A或A2B)的小分子可以作為潛在的治療劑來減少腫瘤中的免疫抑製性上皮細胞。
A2A受體的拮抗劑(例如,CPI-444)或其遺傳失活,已經顯示在弱免疫原性肉瘤模型中促進強抗腫瘤CD8 + T細胞應答並改善其他鼠腫瘤模型中的ICI應答。最初被探索用於治療帕金森病的幾種A2A拮抗劑現在已經被重新用於免疫療法,並且正在臨床上進行測試,作為單一藥劑或與ICI療法組合,包括vipadenant、SCH 420815、PBF 509、AZD4635和CPI-444。
最近報導了CPI-444的初步臨床結果,發現在多種腫瘤類型中單獨/與抗PD-L1組合具有抗腫瘤活性。因此,有理由相信A2A拮抗劑可以恢復患者的CD8+ T細胞反應,從而改善腫瘤生長的免疫控制。實際上,A2A目前被認為是缺氧-腺苷能軸中具有最高價值的分子靶標。
TGF-β抑製劑
TGF-β是一種細胞因子,能夠被Treg細胞當作免疫抑製信號,同時也是被廣泛研究的癌症細胞因子。惡性腫瘤會釋放大量的TGF-β,使癌細胞快速分裂,同時藉助調節性T細胞抑製免疫細胞對它們的殺傷。可以說,TGF-β兼具腫瘤免疫抑製和致癌活性。
與導致免疫抑製的TGF-β信號轉導相一致,TGF-β1R1激酶/Alk5的藥理學抑製可以引發免疫激活和與免疫療法的協同作用。因此,TGF-bR1激酶/Alk5抑製劑galuniseritib目前正在臨床試驗中與胰腺癌中的抗PD-L1治療(Durvalumab/Imfinzi)相結合。
此外,默克研發了雙特異性融合蛋白M7824,一端是識別結合PD-L1的抗體(M7824的PD-L1部分是基於Avelumab開發的),另一端是靶向TGF-β的受體,能夠同時阻斷相互獨立又彼此互補的PD-L1通路和TGF-β通路,進而促進免疫細胞對腫瘤細胞的殺傷。現已迅速進入臨床計劃,目前共有1,316名受試者。
默克大膽採用腫瘤免疫秘密武器,同時靶向PD-L1與TGF-β的融合蛋白有望創造10億市場丨醫麥猛爆料
結語
基於目前通過從發現到臨床測試的發展連續性的各種小分子免疫療法,我們有理由保持樂觀。與基於生物學的療法一樣,這些小分子免疫療法理論上可以增強抗腫瘤免疫活性,並且提供了優於生物免疫療法的固有優勢,可以進入更廣泛的分子靶標、減少生物學治療所見的免疫相關不良事件等。
此外,未來開發基於小分子的免疫療法的一個重要考慮因素是經濟學,鑒於其較低的生產和開發成本,小分子療法有望為更多患者提供免疫療法,無論其財富或國籍如何。
這些療法可能會作為癌症治療中的單一療法、與生物製劑相結合或與傳統的癌症療法(如化學療法和放射療法相結合),尚待進一步確定。然而,鑒於在這個領域分子靶標的廣泛性以及最近的一些失敗,有理由採取謹慎的選擇。