作者:做葯的土豆
免疫系統在腫瘤監測和清除的進程中起著非常重要的作用,腫瘤細胞在多種機制的幫助下做出免疫逃逸被認為是癌症進展的標誌之一。作為免疫療法的重要代表,免疫檢查點抑製劑(Immune checkpoint inhibitor,ICI)對一些轉移性癌症患者非常有益,但通常需要預測性生物標誌物來診斷患者。自腫瘤突變負荷(TMB)與免疫治療獲益之間的密切關係被揭示以來,圍繞TMB的研究也越來越豐富。去年10月,美國NCCN(綜合癌症網路)將TMB正式列入非小細胞肺癌(NSCLC)指南,最近一期的Nature Genetics雜誌發表了一篇關於TMB的研究文章,為TMB作為免疫療法標誌物落下了「實錘」。
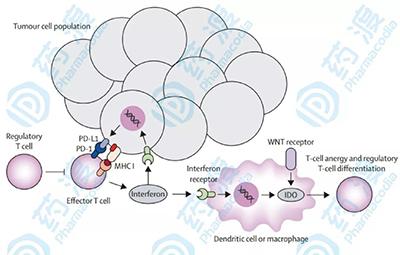
腫瘤微環境中的免疫應答過程(圖片源自參考文章3)
以TMB作為標誌物臨床早已有應用,在CTLA-4抑製劑治療黑色素瘤,PD-1/PD-L1抑製劑治療黑色素瘤、膀胱癌和NSCLC中均有觀察到高突變負荷TMB和臨床效益之間的關聯性。但既往研究ICI治療後TMB與生存率關係的臨床樣本量較小,目前對TMB是否具有各種癌症臨床獲益的預測性尚無十足把握,也不清楚這種獲益一旦超出臨床特定試驗人群後是否還有效。為了獲得更廣泛地數據,這項最新研究共囊括1662名接受ICI治療晚期癌症和5371名未接受ICI治療患者的臨床和基因組數據,並對這些患者的腫瘤採用了新一代靶向測序技術MSK-IMPACT。結果發現在所有患者中,高TMB(不同腫瘤組織均值約20%)與較好的總生存期(OS)呈正相關,證明在大多數癌症中,TMB升高與生存率提高之間存在相關性。

不同癌症TMB的閾值與死亡危害比之間的關係(圖片源自參考文章2)
此外,該研究還對每個癌症類型進行了區別性分析,將每個組織學中突變負荷最高的前20%作為該癌症類型的TMB高組。這樣操作的原因是TMB在不同組織學中分布不同,每種癌症類型TMB前20%的閾值存在顯著差異,也就是說不可能有一個通用的閾值定義「何謂高TMB」,來預測ICI在所有癌症類型中的臨床效益。這種不同腫瘤組織學的TMB差異以及對ICI應答閾值的差異很可能是由於腫瘤微環境造成的,包括單克隆免疫滲透、免疫細胞排斥、人類白細胞抗原基因型變化和檢查點分子的表達水準等因素。

TMB程度在不同癌症類型中的分布情況(圖片源自參考文章2)
這種分層研究更有利於觀察不同癌症類型的OS與TMB的關聯,雖然可能由於樣本量的原因,對個別癌症(如膠質瘤)的影響沒有達到統計學意義,但幾乎所有類型的癌症都觀察到了高TMB與整體生存率較高的大趨勢,這些都說明TMB與ICI術後生存率提高之間的關係可能存在於大多數癌症類型中。TMB在許多癌症組織學上作為一個連續變數,在較長的OS中都能觀察到類似的標誌物關聯性趨勢。與OS的改善一致,在如NSCLC、黑色素瘤、食管胃癌、頭頸癌和腎細胞癌等類型中,TMB與ICI的客觀緩解率(ORR)或PFS之間也存在類似的相關性。

TMB程度與總生存期之間的關聯性(圖片源自參考文章2)
研究人員還對5371名轉移性癌症並且沒有接受過ICI治療的患者腫瘤做了MSK-IMPACT測序,在這些患者中,TMB的升高與OS的提高沒有關聯性。這就排除了這種TMB與患者生存率的正關聯僅僅是由預後患者間的TMB差異導致的,而與ICI治療無關這樣一種可能。
這項研究成果解決了腫瘤免疫學中幾個重要的基本問題:一是驗證了突變負荷可以用來預測接受抗CTLA-4或抗PD-1治療患者的生存率。二是這項研究採用了迄今為止使用ICI治療的最大規模患者基因組數據,可以對TMB的臨床療效影響進行量化分析,證明較高TMB與較高OS之間的持續相關性。最後,研究發現對「高」TMB的定義要因癌症不同類型而異,很難用一個通用閾值來預測所有癌症患者從ICI獲益的可能。總之,這一發現再次強調了TMB作為預測性生物標誌物的可靠性,具有重要的臨床價值。

TMB作為標誌物對ICI治療NSCLC的臨床獲益預測(圖片源自參考文章2)
鑒於免疫治療的潛在毒性和對ICI的高度可變反應,以及這類療法的巨大經濟成本,迫切需要能夠用來預測指導ICI用藥的陽性或陰性預測生物標誌物。陽性預測可以正確判斷哪些患者能夠產生治療響應;而陰性預測用來確定哪些患者從當前療法中無法獲益。利用生物標誌物可以對患者進行單葯或聯合用藥的分組,或是決定將免疫療法用於不同患者群的一線和挽救治療,或是採用替代療法以避免不必要的毒性。除TMB外,目前已驗證具有免疫療法生物標誌物作用的有PD-L1表達、淋巴細胞浸潤水準、T細胞受體克隆性、外周血標誌物、免疫相關基因表達以及多路復用免疫組化等,下面簡要介紹一下。
1、PD-L1表達
在Nivolumab用於黑素瘤、NSCLC、腎細胞癌、攝護腺癌和結直腸癌的I期臨床研究中發現,通過檢測腫瘤細胞的PD-L1表達可以作為抗PD-1、PD-L1治療的生物標誌物。將5%設定為腫瘤細胞PD-L1陽性閾值,在25例PD-L1陽性患者中有9例(36%)對Nivolumab出現ORR,陰性患者中沒有表現出ORR,在晚期黑色素瘤和NSCLC患者中陽性組比陰性組的PFS和OS也都有顯著提高,FDA已批準將PD-L1伴隨診斷用於晚期NSCLC和膀胱癌的治療。但是受PD-L1表達多機制調控和腫瘤微環境影響,PD-L1的表達具有取樣時間差異、患者個體差異、甚至瘤內異質性,其陰性預測作用要低很多。
儘管存在這些局限性,PD-L1表達在免疫療法確定受益患者群仍發揮著重要作用,特別是在相關臨床試驗中,確保PD-L1陽性腫瘤患者在比較群組中的平均分布是非常必要的,可以避免由生物學差異而引入的實驗偏差。
2、淋巴細胞浸潤水準
許多癌症的回顧性研究都發現,淋巴細胞的浸潤程度與患者生存率有關聯,在實體腫瘤聚集處,如結直腸癌和黑色素瘤中發現異位淋巴結狀結構能夠更好地預測患者生存。例如,與CD8+腫瘤浸潤淋巴細胞程度較低的放化療III期NSCLC患者相比,腫瘤浸潤程度高的患者群PFS和OS都更長。這種淋巴細胞浸潤程度的背後機理被認為是能夠激起自身免疫應答或T細胞炎症腫瘤表型,通過免疫機制改善疾病控制,因此可以作為預後生物標誌物。
3、T細胞受體克隆
研究發現腫瘤淋巴細胞浸潤的T細胞受體靶向腫瘤特異性免疫反應,與Pembrolizumab的臨床應答相關,結果表明基線T細胞受體克隆性與腫瘤浸潤淋巴細胞密度的相關性不高。當浸潤淋巴細胞限制了T細胞受體對腫瘤抗原的特異性克隆,即便是腫瘤浸潤淋巴細胞密度較低的患者,仍然可以在抗PD-1治療中獲益。當然這種假設尚需要從大量臨床試驗中得到進一步驗證,並且可能還需要確認可識別的腫瘤抗原,然後才能將該方法應用於生物標誌物。
4、外周血標誌物
外周血標誌物的優勢在於非侵入性的樣品採集方式,雖然這類標誌物與臨床療效的一些關聯性已有研究,但是尚未有這類標誌物真正「落地」具備療法預測性。以Ipilimumab為例,相關臨床研究發現以下指標與患者PFS有關,包括低絕對中性粒細胞計數(< 7500個細胞/μL),中性粒細胞淋巴細胞比例低(< 3),絕對的單核細胞計數低(< 650細胞/μL),低頻髓樣抑製細胞(< 5·1%)、高頻FoxP3+調節性T細胞(≥1·5%),高頻率的淋巴細胞(≥10·5%),以及高嗜酸性粒細胞計數(≥50個細胞/μL),在抗PD-1治療研究中也發現了一些類似的結果。此外,外周T細胞數量,尤其是T細胞受體基因序列或對新抗原的反應性評估也可以作為一種預測生物標誌物發揮潛在作用。
5、免疫相關基因表達
通過基因表達對腫瘤微環境中活躍的先天或適應性免疫反應進行更廣泛的評估,可以有效地預測ICI療法的臨床效益。對晚期黑色素瘤患者使用Ipilimumab的II期臨床回顧性分析證明,基因表達譜圖確實是一種有用的預測生物標誌物。研究人員提取了50份治療前腫瘤活檢標本的總RNA進行分析,將患者分為有臨床應答和無應答兩組,對兩組之間存在顯著差異的基因進行通路分析後發現關聯炎症反應。22個與免疫相關的基因表達至少增加了2·5倍,包括細胞毒性T細胞(如CD8A、顆粒酶B、穿孔蛋白I)、Th1細胞因子或趨化因子、MHCII類和其他免疫相關基因(如NKG7、IDO1)的標誌物,均與OS延長相關。
6、多路復用免疫組化
通過多重免疫組化技術直接評價腫瘤和免疫細胞表型及其空間關係,提供了腫瘤微環境免疫狀態的信息,這些信息可以作為基因表達譜的補充。包括用單個初級抗體對腫瘤切片進行連續染色,以獲得感興趣的蛋白質,並用顯色或免疫熒光法進行檢測,這種多光譜方法在臨床應用中具有很大的潛力。通過建立多光譜免疫組化平台,分析黑色素瘤載片上的CD3、CD8、FoxP3、CD163和PD-L1,預測哪些患者能夠成功生成腫瘤浸潤淋巴細胞,選擇合適的細胞療法。僅CD8+ T細胞的存在不足以預測腫瘤浸潤淋巴細胞的成功生長,但是CD8+ T細胞與CD3+FoxP3+調節性T細胞比值與腫瘤浸潤淋巴細胞的成功生長密切相關。PD-L1+的加入使陰性預測值提高了100%,這種方法也可以應用於其他免疫療法。
7、標誌物合用策略
將兩種或兩種以上標誌物策略聯合使用來捕捉腫瘤微環境免疫狀態,可以對ICI治療更有效。以PD-L1表達和淋巴細胞浸潤為例,兩者可能在腫瘤細胞呈現相反的情況,PD-L1表達較高時腫瘤浸潤淋巴細胞計數較低,反之亦然,在這種情況下,抗PD-1或抗PD-L1單一治療的臨床響應可能較低,而僅以PD-L1表達或腫瘤浸潤淋巴細胞密度作為生物標誌物,會產生錯誤的預測。同樣,並非所有高突變或新抗原負荷腫瘤都表現出「先天」的免疫性,這被認為是免疫治療方法的先決條件之一。腫瘤微環境中還存在多種並發免疫抑製機制,包括CTLA-4、PD-L2、LAG3、IDO1和IL-10,隨著新的聯合治療策略的出現,這些都可能成為重要的識別靶點。
參考文章:
[1]BMS Withdraws Application for Nivolumab/Ipilimumab in TMB-High NSCLC.
[2]Tumor mutational load predicts survival after immunotherapy across multiple cancer types.
[3]Predictive biomarkers for checkpoint inhibitorbased immunotherapy.
[4]Approaches to treat immune hot, altered and cold trumors with combination immunotherapies.