註:本文為肝臟時間微信公眾號略曉薛一家之言,其中個人觀點必有不少紕漏和錯誤,個人搜索最新數據能力也有限,歡迎廣大讀者指正和批評並提供最新數據供大家共享。本文目的在於分享更多公開資訊,拓展在研B肝新葯認知,歡迎掌握更多相關資訊讀者將文中未能提及的資訊分享出來大家共享。文中涉及幾乎所有數據均可在肝臟時間微信公眾號或一諾醫學網站的原創文章中找到,相關數據均來源國內外企業和研究所公開公布資訊,可在各大官方網站或期刊以及會議論文摘要中查得,對詳細數據感興趣的讀者可去肝臟時間微信公眾號歷史文章中或到一諾醫學網站中或者國外相關官網查找。本文涉及參考文獻量非常多,故在文末中省略,敬請見諒!
據發表在2018年3月的柳葉刀子刊(The Lancet Gastroenterology & Hepatology)上的最新研究結果表明,全球目前約有3.0億左右的慢性B肝病毒感染者(包括慢性乙型肝炎患者和B肝病毒攜帶者),其中主要集中在東亞,南亞,拉哈拉以南的非洲等地區[1],由於慢性乙型肝炎病毒感染者眾多,現已經成為全球重要的公共衛生問題。
乙型肝炎病毒(HBV)感染的遷延不愈可導致肝纖維化、肝硬化甚至肝細胞肝癌。現階段我國約有1億的慢性B肝病毒感染者,而我國每年新發肝癌病例約佔據全球的59%,這其中絕大多數肝癌病例由B肝病毒感染和C肝病毒感染所導致。C肝病毒感染自2013年首款口服直接作用抗病毒藥物(DAA)面世後目前治癒率已經達到95%以上,而慢性乙型肝炎的治癒則仍有待基礎研究和藥物研究的突破。
目前已批準可用的慢性乙型肝炎治療藥物有干擾素類和核苷(酸)類似物兩大類。前者代表藥物有聚乙二醇干擾素α-2a(派羅欣)、聚乙二醇干擾素α-2b(佩樂能)和普通干擾素,國內近期獲批上市的樂復能(Novaferon)本人認為屬於類干擾素類藥物;後者代表藥物有拉米夫定、阿德福韋酯、恩替卡韋、替比夫定、Levovir (Clevudine)、Besivo (besifovir) 、富馬酸替諾福韋二吡呋酯(TDF)、替諾福韋艾拉酚胺(TAF)。但這兩大類藥物均只能通過抑製病毒複製來延緩病情,治癒率非常有限,無法實現大範圍的徹底治癒,多數使用口服藥物的患者需要終生用藥。部分患者在現有藥物治療過程中不少出現耐葯,甚至包括替諾福韋(TDF)耐葯(韓國2017年已有公開的耐葯病例報導)。針對替諾福韋耐葯病例,研究人員認為新型作用機制藥物或成為唯一選擇,因此,開發新型治療方法毫無疑義成為當前迫切需求。
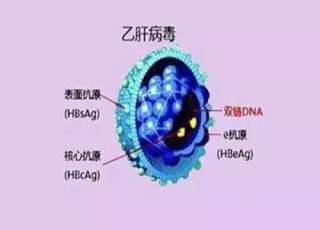
B肝病毒從進入人體附著到肝細胞並在肝細胞內組裝再釋放到血液過程中有多重步驟(參見下圖)。目前的核苷(酸)類似物通過抑製病毒DNA多聚酶和逆轉錄酶的活性,同時競爭性抑製核苷酸進入病毒DNA鏈,終止病毒DNA鏈的延長,干擾病毒DNA的合成,從而發揮抗病毒作用。干擾素則並不直接殺傷或抑製病毒,主要通過細胞表面受體作用使細胞產生抗病毒蛋白,從而抑製B肝病毒的複製;同時還可增強自然殺傷細胞(NK細胞)、巨噬細胞和T淋巴細胞的活力,從而起到免疫調節作用,並增強抗病毒能力。而新型治療藥物將靶點瞄向B肝病毒全生命周期中各個環節,包括靶向B肝病毒進入肝細胞、HBx蛋白、cccDNA形成、RNA干擾、HBsAg形成分泌等等,進而開發針對單一靶點或同時作用多個靶點的治療藥物。這些藥物目前已有部分進進入臨床研究試驗,但也有部分仍處在臨床前研究階段。

圖片來源:柳葉刀子刊(The Lancet Gastroenterology & Hepatology)
以下僅就本人掌握的2108年有公開進展消息的在研B肝新葯進行簡要介紹:
1. 核苷(酸)類似物
當今慢B肝治療藥物中使用量最大的藥物非核苷(酸)類似物莫屬,此類藥物雖無法徹底治癒、停葯後也極易反彈、且用藥過程中的耐葯問題也較為突出,但作為當前可選不多的藥物之一實屬無奈。目前國內外均有不少廠家對此類藥物進行更新換代,其中主要以開發替諾福韋(TFV)的前葯為主。
海普諾福韋(HTS)
海普諾福韋為西安新通藥物研究有限公司和廣州奇方葯業有限公司共同申報的1.1 類新葯,據悉,該葯日前已獲批準進入臨床研究。該藥物為西安新通在其具有自主知識產權的國家「十三五」重大新葯創製「HepDirect」技術平台基礎上研製的第二代B肝靶向新葯,屬於替諾福韋前葯,能靶向性地將藥物活性產物投放到肝臟,濃集於肝臟,達到增效減毒作用。大鼠研究表明,該葯的肝腎比是替諾福韋的13.4倍,在具有更強和更持久療效的同時,可以顯著改善腎功能和骨骼安全參數。動物藥理研究顯示,相比替諾福韋,海普諾福韋的用量更小,停葯後二周病毒無明顯反跳,有望開發為低毒長效口服製劑。
HS-10234片
HS-10234是翰森製藥(豪森葯業)自主研發的抗病毒1.1類創新葯,是一種核苷類逆轉錄酶抑製劑,預期可用於B肝治療。HS-10234是新一代單磷醯胺單酯類的替諾福韋前葯,在血漿中非常穩定,因此可提供一種既能提高療效又能降低毒性與副作用的新型替諾福韋前葯。目前正進行HS-10234的III期臨床試驗,預計於2019年向國家食葯監總局提交新葯申請,並於2020年在中國獲批上市。
TXL (CMX 157)
TXL (CMX 157)是美國 ContraVir 公司開發的在研新葯,是一種新型的無環核苷膦酸酯替諾福韋(TFV)前體藥物。藥物通過酯化作用將TFV轉化成部分類脂,再藉助細胞的自然脂類吸收路徑,使口服生物利用度和細胞靶向作用獲得提升,藥物在細胞內通過將CMX157轉化成TFV二磷酸的形式發生作用。
2018年3月TXL (CMX 157)獲得美國食品藥品監督管理局(FDA)授予用於兒童(0至11歲)慢B肝治療的孤兒葯資質。
目前該葯已經在做 Phase II 期臨床並在確定最佳的用藥劑量(從目前做的試驗看估計最終劑量跟TAF不相上下),在跟富馬酸替諾福韋二吡呋酯(TDF)進行對照的 II 期研究中該葯的安全性和耐受性良好,不良反應發生率和實驗室檢查結果異常兩者相似,沒有因藥物嚴重不良反應而停葯的事件發生,沒有劑量限制性毒性或劑量依賴不良反應事件。
而在患有嚴重腎損傷(RI)受試者中進行的 phase I 期開放標籤研究顯示,該葯50mg每日的劑量觀察到替諾福韋(TVF)暴露與300mg替諾福韋(TDF)暴露相當,表明該葯對於嚴重腎損傷(RI)患者不需要進行劑量調整。
國內有關該葯的消息:據福建省肝病藥物研究重點實驗室近期公開公布的2018年度開放課題評審結果通知顯示,國內企業南京天海醫藥科技有限公司正式開始對 ContraVir 公司的在研B肝新葯CMX157(現在正式名稱:TXL)及其類似物的合成展開研究工作(個人理解為仿製)。
2.RNA干擾(RNAi):干擾和破壞病毒RNA
RNA干擾(RNAi)技術誕生於上世紀90年代,是研究人員在研究秀麗新小桿線蟲(C. elegans)反義RNA(antisenseRNA)過程中發現的,是一種生物在進化過程中高度保守的、由雙鏈RNA(double-strandedRNA,dsRNA)介導的同源RNA高效特異性降解現象。2006年兩位美國人因在RNAi機制研究中的貢獻獲得諾貝爾生理及醫學獎,12年後的2018年,首款RNAi療法藥物獲得美國藥品監管部門批準上市,隨後歐洲藥品監管部門也批準了該療法藥物的上市,藥物是由 Alnylam 公司研發用於成人遺傳性轉甲狀腺素蛋白(hATTR)澱粉樣變性引起的周圍神經病變治療的新葯ONPATTRO? (patisiran)脂質複合物注射液。
針對慢B肝治療RNAi主要靶向B肝病毒的前基因組RNA(pgRNA)和mRNA水準。自發現至今已有較多研究人員將該技術用於乙型肝炎病毒感染的治療探索,現已有多款採用RNAi 技術的藥物進入人體臨床試驗。較有代表性的要數 Arrowhead 公司的 ARC-520、ARC-521 和 ARO-HBV,Alnylam 公司的 Vir-2218(ALN-HBV02),Arbutus 公司的ARB-1467 、ARB-1740 和 AB-729 ,Roche 公司的 RG6004 ,Benitec 公司的 BB-103,Arcturus公司的 Lunar-HBV,Dicerna 公司的 DCR-HBVS。
ARC-520
ARC-520 是由 Arrowhead 公司研發的一款針對慢B肝的RNAi新葯,也是最早進入Phase II期臨床的RNAi在研B肝新葯,用的是 Arrowhead 公司的專有技術EX1進行藥物遞送。該葯研發進程並非一帆風順,臨床研究期間被暫停過後又獲得重啟,然而在2016年11月由於出現用藥非人類靈長類動物的死亡最終公司還是決定終止了該藥物的研究,相較而言該藥用於人體的臨床試驗還較為安全。
在今年的歐肝會上,Arrowhead 公司還公布了患者在使用了 ARC-520 停葯半年後的隨訪結果,在該結果中觀察到HBeAg陽性患者 HBsAg 平均下降 3.0 log ,max 下降4.6log,有1例患者實現 HBsAg 水準下降到 1 IU/ml以下。HBeAg 陽性患者 HBcrAg 平均下降 3.4 log ,max 下降 6.1log。HBeAg陰性患者 HBsAg 平均下降 1.0 log ,max 下降2.1log, 但只有1名患者 HBcrAg 下降 0.7 log 並且仍處於陽性狀態。
另據今年發表在 Science Translational Medicine 雜誌上的該藥用於慢性HBV感染者和黑猩猩的研究治療表明整合到宿主基因組中的 HBV DNA 可作為 HBsAg 的來源,該研究主要研究人員 Christine I. Wooddell 博士說「對該領域來說這是一個重要的發現並具有廣泛的影響,因為以前認為病毒蛋白的產生僅僅依賴於B肝病毒cccDNA的轉錄。我們現在可以知道,整合 HBV DNA 也是可以生產循環 HBsAg 的一種方式,而不是僅僅依賴於病毒複製,其還可能在持續抑製免疫系統中起作用,並允許持續的病毒粒子生產。只要有幾個能夠逃避免疫監視的含cccDNA 的細胞就可以保持持續的慢性感染,因此,只有實現對 HBsAg 的完全免疫控制方可以預防停葯後的感染複發,並實現功能性治癒。」
ARC-521
ARC-521是Arrowhead 公司開發的第二款針對慢B肝治療的RNAi新葯,作為ARC-520的補充,該款藥物公司更希望針對的是那些低 cccDNA水準的患者。然而在Arrowhead計劃在健康志願者和HBV患者中進行關於ARC-521 的單劑量和多劑量Phase 1/2 期臨床試驗後不久,便曝出採用EX1技術遞送藥物的非人類靈長類動物死亡,最終公司還是決定同ARC-520一樣終止了ARC-521的研究。
ARO-HBV
自終止了ARC-520 和ARC-521 的研究研究後,Arrowhead 公司利用專有的皮下(subQ)和肝外輸送系統重新開發了 RNAi 療法藥物,用於慢B肝治療的藥物目前已知有 ARO-HBV,該葯已經開始了Phase I/II期臨床試驗。
在舊金山召開的 2018 美國肝病學會(AASLD)年會上 Arrowhead 公司公布了該葯Phase 1 期臨床試驗結果。結果顯示健康志願者組和慢B肝患者組用藥後均沒有嚴重的AE病例報告,兩組的AE均為輕度,約有11%的注射受試者發生輕度注射部位AE,總體而言耐受性良好。
而受試的慢B肝患者在與NUC聯合用藥後 HBsAg 的最大降幅鋼彈4.0 log10,並且已經到第85天監測時間點的各個劑量組( 100, 200, 300 或 400mg 用藥)慢B肝患者均實現HBsAg降低> 1.0 log10。在第二劑和第三劑用藥後還觀察到了額外的HBsAg降低。
在研究的24名慢B肝患者中,21名基線時HBsAg> 100 IU / ml,目前有17名達到HBsAg<100, 7名≤10, 4名≤1。基線時其他病毒參數均在LLOQ以上的慢B肝患者中,ARO-HBV 用藥後均有所改善,包括降至BLQ以下的:HBV DNA(2/7),HBV RNA(8/14),HBeAg(0/11)和 HBcrAg( 3/15)。
Vir-2218(ALN-HBV02)
Vir-2218 是 Alnylam 公司用增強穩定化學加(ESC +)GalNAc結合物遞送平台開發用於慢B肝治療的 RNAi 新葯,之前稱為ALN-HBV02,公司將其授權給Vir Biotechnology進行臨床開發後改名為 Vir-2218 。最近公司已跟Vir Biotechnology聯合宣布將 VIR-2218 推進 Phase 1/2 期臨床。
VIR-2218 的設計初衷旨在抑製所有HBV蛋白的表達,包括乙型肝炎表面抗原(HBsAg)。有研究認為病毒蛋白的敲低可能有助於恢復患者自身對HBV的免疫反應,從而為患有慢性HBV感染的人提供功能性治癒的潛力。目前暫未有更多關於 VIR-2218的詳細研究資訊披露。
之前Alnylam 公司曾開發過另一款用於慢B肝治療的 RNAi 新葯ALN-HBV,並於2016年將其推進到了Phase 1/2期臨床,之後沒有進一步的消息公布。這款新葯是採用增強穩定化學(ESC)-半乳糖胺-RNA干擾共軛傳遞平台開發,VIR-2218 與 ALN-HBV 的開發平台有所不同。在嚙齒類HBV感染動物模型中的臨床前研究數據表明,皮下注射ALN-HBV能夠產生強大而持久的使HBsAg下降的能力。在小鼠單劑量的ALN-HBV研究中,單劑量應用後15天能夠引起最鋼彈3.6log10,平均1.6 log10 HBsAg的下降。此外,在大鼠ALN-HBV多劑量應用表現出更高強度的下降,ALN-HBV 3mg/kg的劑量每周一次,持續三周,效果可持續長達4個月。在大鼠和靈長類動物13周的藥品非臨床研究品質管理規範(GLP)毒理學研究中 ALN-HBV 的耐受性良好。
ARB-1467
ARB-1467 是 Arbutus 公司使用專有的脂質納米顆粒(LNP)遞送技術開發用於慢B肝治療的一代 RNAi 藥物,是一種含有三個雙鏈小干擾RNA(siRNA)的脂質納米顆粒(LNP)製劑,其靶向B肝病毒基因組中的三個不同位點,以實現由cccDNA和整合DNA產生的HBV蛋白的轉錄後基因抑製,包括B肝表面抗原(HBsAg)。臨床前研究中該葯表現出了降低B肝病毒抗原如 cccDNA 和 HBV DNA 水準的能力。
據此前公布的Phase 2a/2b期臨床研究結果,隊列1-3(共24例,含對照受試者)中接受核苷類似物治療已穩定控制病毒的慢B肝患者接受每月一次用藥,共3劑,隊列4為每兩周用藥一次,共5劑。隊列1-3中持續用藥患者的 HBcrAg 和 HBsAg 降低較多,6/11 對象的 HBsAg 降低大於 1 log,其中隊列2 以0.4mg/kg 的用藥劑量觀察到的 HBsAg 下降幅度要比 0.2 mg/kg 用藥劑量的隊列1更大。隊列4(12名受試者)所有患者均經歷血清B肝表面抗原(HBsAg)水準下降,平均下降 1.4 log10(最大下降2.7 log IU/mL),比之前每月用藥一次的隊列1-3患者下降幅度大,12名患者中有7名達到預定的應答標準(血清 HBsAg 下降至少1個log10 且血清HBsAg水準低於1000 IU/mL)。
新研究已經正在進行,採用每兩周用藥一次,為期30周,並跟核苷(酸)類似物和干擾素進行聯合用藥研究,主要評估在有限的治療期內對當前治癒率改善情況。迄今為止,已有6名HBV患者入組並接受了治療。根據方案,3名患者在第6周未達到預定的應答標準以進行PEG-IFN治療。 2名患者尚未進展至6周分析點以確定是否需要添加PEG-IFN。1名患者的反應強烈,治療第14周時HBsAg水準降低3.17 log,低於4 IU / mL,基線水準大於6000 IU / mL,表明該方案可能使某些患者的HBsAg水準降低到無法檢測水準。該研究仍然在繼續入組新的受試對象,公司將定期提供數據更新。
ARB-1740
ARB-1740 是 Arbutus 公司開發的二代RNAi療法藥物,ARB-1740使用的是跟ARB-1467同樣的脂質納米顆粒(LNP)遞送技術,區別在於它使用了不同的RNAi觸發分子(RNAiTrigger Molecules)。在臨床前試驗中,ARB-1740彰顯出了更大的潛力。但在Phase II期臨床中發現該葯的效用與ARB-1467相比無明顯的優勢,因此,Arbutus決定終止開發ARB-1740,繼而繼續推進ARB-1467。
AB-729
AB-729 是一種靶向HBV的皮下注射GalNAc結合物,是 Arbutus 公司正在開發的第二代RNAi製劑。在臨床前研究中,AB-729 顯示出有效且持久的HBsAg降低。該藥物預計將於2019年第二季度進入臨床研究,並可能在2019年下半年的臨床研究中與AB-506(一種用於B肝治療的在研核心蛋白變構調節劑(CpAM))聯合使用。
RG6004(RO7062931、HBV LNA)
RG6004 是 Roche 公司的一款針對慢B肝治療的在研RNAi藥物,根據公開消息顯示該款藥物正在進行Phase 1期臨床試驗,目前未見有關該葯的詳細公開資訊。
LUNAR-HBV
LUNAR-HBV 是 Arcturus公司跟強生公司旗下楊森聯合開發的一款針對慢B肝治療的藥物,是一種3個UNA寡聚物的組合,靶向所有的HBV轉錄物並涵蓋所有的公開的HBV序列,是迄今為止報導的單一藥劑中HBV基因型覆蓋最全面的。LUNAR-HBV在HBV感染的人肝細胞和兩種HBV感染的小鼠模型中顯示出有效的抗HBV活性。3個UNA寡聚物的組合也使病毒耐藥性發生的可能性最小化。基於其有效的降低HBxAg和其他病毒產物,以及重新激活抗病毒免疫的潛力,LUNAR-HBV有可能成為新一代HBV療法的基石。
目前該葯仍處在臨床前研究階段。
DCR-HBVS
DCR-HBVS 是 Dicerna 公司開發的一款針對慢B肝治療的RNAi療法藥物,DCR-HBVS靶向HBV信使RNA,並能使HBV感染小鼠模型中循環HBsAg減少99%以上。公司在2018AASLD上發表的研究結果顯示,在給表達HBV基因組的小鼠用藥後,靶向HBsAg編碼區內的 GalXC 製劑表現出了優異的活性持續時間,並且還抑製了cccDNA轉錄活性指標的核HBcAg的積累。
目前該葯仍處在臨床前研究階段。
BB-103
BB-103 是 Benitec 公司使用RNA干擾(RNAi)技術設計用於慢B肝治療的重組腺相關病毒8型(AAV8)基因治療載體。該載體使用三個野生型pol III啟動子來驅動三個短髮夾RNA的表達,每個嵌入在miRNA主鏈內,以同時靶向HBV病毒RNA上的核心,S抗原和X蛋白區域中的三個保守序列。
在嵌合小鼠模型研究中,BB-103 單葯治療70天,跟未治療PXB小鼠相比,單劑量BB-103 使血清 HBV DNA下降1.98 log。BB-103 聯合 PegIFN 的血清 HBV DNA 下降 2.85 logs。 BB-103 聯合恩替卡韋在70天內 HBVDNA 水準降到檢測下限以下。雖然56天的恩替卡韋治療 HBsAg隻降了0.39 logs,而單劑量的 BB-103 用藥治療 HBsAg 卻降了2.05 logs,在加用恩替卡韋後 HBsAg 更是降了2.07 log。類似的,BB-103 單葯治療後HBeAg 水準降低 1.71 logs,而跟恩替卡韋聯用後也隻降了 1.71 logs 。
然而,由於該藥物使用病毒衣殼進行全身遞送較具挑戰性,實際製造也有不少挑戰,於是 Benitec 公司對該藥物進行了改進,在突破了具有產生持久基因表達能力的封閉末端線性雙鏈(Closed-Ended Linear Duplex,CELiD)DNA載體藥物遞送技術後,公司將該藥物使用該技術在HBV小鼠模型中進行驗證,用藥第70天,CELiDDNA導致血清 HBV DNA 降低1.75log(低於LLOQ)。與對照組相比,CELiD DNA 使血清 HBsAg 降低 1.89 log , HBeAg 降低 0.89log (均低於LLOQ)。在整個70天的實驗中,HBV病毒載量持續下降,血清HBV參數沒有反彈。
3.進入抑製劑:干擾HBV進入肝細胞
2012年北京生命科學研究所李文輝團隊率先發現並提出鈉離子-牛磺膽酸-協同轉運蛋白(NTCP)受體是HBV 感染細胞的功能性受體,病毒進入抑製劑的研究大門由此開啟,該類藥物通過對肝細胞表面 NTCP 受體的抑製進而防止B肝病毒進入正常肝細胞。目前針對此類藥物的研究已有較多,但多數尚未開展臨床試驗,已開展臨床試驗的有代表性的要數 MYR Pharma 公司的 Myrcludex B ,其它如環孢菌素A(CsA)、環孢菌素A衍生物、依澤替米貝、原花青素、羅格列酮(rosiglitazone)、扎魯司特(zafirlukast)、TRIAC 、柳氮磺胺吡啶(sulfasalazine)、滂胺天藍(chicago sky blue 6B)等在體內外實驗環境中被證明可以一定程度的抑製NTCP受體從而限制 HBV 感染,但目前均未見有公開的臨床試驗報導。
Myrcludex B
Myrcludex B 是 MYR Pharma 公司研發的首款病毒進入抑製劑,也是目前唯一一款進行了臨床試驗的病毒進入抑製劑,它的抗病毒作用機制為高度特異性、高度穩定的結合和失活肝細胞表面蛋白NTCP,通過阻斷NTCP,MyrcludexB 誤導 HBV 和合併感染的HDV到非生產性途徑,從而防止正常細胞感染。
Phase 2a臨床研究結果顯示,40例HBeAg陰性慢B肝患者(所有HBV DNA>2000 IU/ ml,平均HBV DNA為4.7log10 IU/ml;無肝硬化),每日使用一次Myrcludex B sc 0.5mg、 1mg、 2mg、 5mg 和 10mg 治療12周(每種劑量8例患者)。有3例Myrcludex B 治療患者 (10mg組) 發生注射側皮炎,經治療後消失。觀察到8例接受10mgMyrcludex B治療的患者中有6例(75%)在第12周出現HBV DNA下降>1log10,而其他劑量組中未見(7/40;17%)。 40例患者中有22例(55%)ALT恢復正常,平均ALT值從治療前的76 U/l下降至12周時的36 U/l(P <0.001)。HBsAg水準均沒有顯著變化,提示該葯對HBsAg作用有限。
Phase 2b 期臨床試驗是在HBV/HDV 合併感染者中進行的,在 2018 美國肝病學會(AASLD)年會上公布了部分研究結果,Myrcludex B單葯治療並未觀察到 HBsAg 出現明顯變化。(更多數據詳情可查看文章:AASLD2018:Myrcludex B與PEG-IFNα聯用具有治癒慢性 HDV 和 HBV感染潛力)
4.衣殼抑製劑
乙型肝炎病毒(HBV)衣殼蛋白裝配抑製劑以病毒的衣殼蛋白裝配(Capsid assembly)為靶點,對衣殼蛋白裝配的阻斷或加快衣殼蛋白降解都會干擾衣殼裝配過程,從而影響病毒複製。全球目前在研的HBV衣殼蛋白抑製劑從化合物結構上主要分為兩大類:異芳基—二氫嘧啶(heteroaryldihydropyrimidines 、HAPs)和磺醯胺類(phenylpropenamides、PPAs),而我國上海摯盟醫藥科技公司在2018年美國肝病年會(AASLD2018)上發布了具有全新骨架的吡唑類化合物CB-HBV-001。
此類在研藥物較多,並且也有不少已經進入人體臨床試驗階段。
GLS4(甲磺酸莫非賽定)
GLS4是由我國東陽光葯開發的一款HBV衣殼蛋白裝配抑製劑,屬於異芳基—二氫嘧啶類化合物,前期1b期研究結果顯示28天GLS4/RTV(利托那韋)聯合治療可有效抑製HBV DNA血清學水準。目前已經進行IIa期臨床試驗,並在2018AASLD上公布了完成20周治療的結果。
20例慢性HBV感染患者分別接受GLS4 120mg BID或TID(隊列A或B)聯合RTV治療,每隊列10例患者。
GLS4對HBeAg陽性和陰性患者的HBV DNA定量均有明顯的抑製作用。根據已有數據,隊列A和隊列B的HBV DNA定量平均最大降幅分別為3.28(1.48~5.58)和4.40(1.51~6.09)log10IU/mL。3例患者的HBV DNA定量達到定量下限以下(LLOQ= 20IU /mL)。隊列A和隊列B HBsAg定量在治療期間平均最大降幅分別為0.20(0.01~0.77)和0.44 (0.00~1.30) log10IU/mL。隊列A和隊列B HBeAg定量平均最大降幅分別為0.57(0.00~1.49)和1.06 (0.14~2.07) log10IU/mL。此外,研究發現GLS4也能顯著降低HBcrAg和HBV RNA的血清水準。
同時,GLS4/RTV在慢性B肝患者中耐受良好,大部分不良事件(AEs)均較輕,且無劑量限制毒性。(詳細數據可查看:AASLD2018:GLS4治療慢B肝IIa期臨床研究取得新進展)
JNJ-56136379(JNJ-6379)
JNJ-6379 是一款由 Johnson 旗下楊森(Janssen)公司研發的HBV衣殼蛋白裝配抑製劑,屬於磺醯胺類化合物,在 2018 美國肝病學會(AASLD)年會上公布的1b 期研究數據顯示,在HBeAg陰性和陽性初治慢B肝患者中,28天的JNJ-6379 用藥安全性,耐受性良好,表現出劑量依賴性PK,並且在評估的所有4個劑量組(25, 75,150 和 250mg )中均產生有效的抗病毒活性。但對 HBsAg 或 HBeAg 似乎無明顯作用。
在2018年全球肝炎峰會(Global Hepatitis Summit 2018)上公布的部分2a 期臨床研究結果顯示,在用藥後的第29天,在所有3個治療組中均觀察到 HBV DNA 和 HBV RNA 從基線顯著降低,但沒有觀察到HBsAg有顯著變化。重複給葯後,藥物暴露以劑量依賴性方式增加,耐受性和安全性良好。
目前該葯已經在進行2期臨床研究。
JNJ-64530440(JNJ-0440)
JNJ-0440 也是一款由 Johnson 旗下楊森( Janssen)公司研發的HBV衣殼蛋白裝配抑製劑,屬於磺醯胺類化合物。在 2018 美國肝病學會(AASLD)年會上公布的體外研究數據顯示, JNJ-0440 可在穩定的HBV複製細胞系和HBV感染的PHH中抑製HBV複製(干擾HBV衣殼組裝),在廣泛的基因型A-H臨床分離株中具有活性,並阻斷PHH中cccDNA庫的形成。
在 2018 美國肝病學會(AASLD)年會上公布的1期研究數據顯示,單劑量JNJ-0440鋼彈900mg安全性依然良好並且在健康受試者中耐受性良好。 PK與劑量成比例,達到預期具有抗病毒活性的濃度,並且支持每日一次口服給葯。在健康受試者的進一步單劑量和多劑量更新研究,以及本研究中HBV感染患者的抗病毒活性評估正在進行或計劃中。
ABI-H0731
ABI-H0731 是 Assembly 公司在研的一款新型核心蛋白變構調節劑(CpAM),能選擇性的靶向病毒核心蛋白,該 HBV 蛋白涉及 HBV 生命周期中多個步驟包括 cccDNA 的形成。
已完成的 Phase1 期研究結果表明,ABI-H0731單葯治療在入組研究的慢B肝患者中耐受性普遍良好,沒有嚴重的不良反應,沒有顯著的藥物相關藥物依賴或因治療出現的實驗室異常。4個劑量組(100, 200, 300 或400 mg)中每組的中位數 - 最大(範圍)log10IU / mL HBV DNA下降範圍從 100 mgQD 的1.5(0.7-3.6)到 300 mg QD 的2.7(0.8-4.0),100mg 和 300mg 隊列 HBeAg 陽性/陰性受試者的中位 log10 IU / mL分別下降1.4 / 2.2 和 3.0 / 2.5。在 300mg 和 400mg 隊列中觀察到相似的最大下降幅度(~4 log10 IU/mL) 。研究還觀察到 HBeAg 陽性受試者的 HBV RNA 下降與觀察到的HBV DNA下降平行。
目前公司已啟動了兩項該葯 Phase 2a 期臨床試驗,研究將會評估該藥單葯或跟核苷(酸)類似物聯合用藥對病毒的效果以及安全性和耐受性,監測的標誌物除了常規的HBV DNA 外還包括HBV S抗原(HBsAg)和HBV E抗原(HBeAg)。
ABI-H0731 在今年7月底獲得 FDA 授予的快速通道認定。
ABI-H2158(ABI-2158)
ABI-H2158 是 Assembly 公司開發用於慢B肝治療的一款在研二代核心蛋白變構調節劑(CpAM)。
Assembly 公司 HBV 項目首席科學家 Richard Colonno 博士在一個專註B肝領域的會議上公布該葯時評論到「我們的HBV項目目標是通過使用我們的直接作用CpAMs靶向必須的病毒核心蛋白從而實現提高慢B肝治癒率,CpAMs 已經在體外研究中顯示能抑製病毒複製以及更重要的步驟——跟病毒耐葯相關的cccDNA形成!在其他的體外研究中,我們的下一代臨床候選產品 ABI-H2158,顯示出具有增強的效力,同時保持跟我們的第一個臨床候選產品ABI-H0731相同的有利的藥物樣(DMPK)特徵。」
目前該葯已經開始進行Phase 1a期臨床試驗。
AB-423
AB-423 是 Arbutus 公司研發的一款核心蛋白變構調節劑(CpAM)。前期研究結果表明,在HepAD38細胞系中,AB-423 可阻斷 pgRNA 衣殼化和cccDNA形成。在HBV細胞培養模型進行的抗病毒效力和細胞毒性評估中,AB-423 對HBV複製表現出有效抑製作用,在跟核苷(酸)類似物或RNAi製劑聯合用藥中表現出有利的抗病毒活性。目前該葯已經著手在健康志願者中進行 Phase 1期臨床試驗。
AB-506
AB-506 是 Arbutus 公司研發的一款二代核心蛋白變構調節劑(CpAM)。體外聯合研究表明AB-506與批準的NA或ARB-1467的體外聯合在降低HBV rcDNA和HBsAg水準上有累積至中度協同作用,對細胞活力沒有顯著影響。
在水動力注射(HDI)HBV小鼠模型中,AB-506 + AB-452,AB-506 + TDF 聯用表現出強烈的抗病毒活性,相對於賦形劑對血清 HBV DNA 的降低平均值分別為1.4,1.9 和 2.2 log,而三聯療法的組合對血清 HBV DNA 的降低影響更大,相對於賦形劑對照組為降低2.8 log。
目前該葯已經在健康志願者和慢B肝患者中進行 Phase 1a/1b期臨床試驗。
RG7907
RG7907 是 Roche 公司研發的一款核心蛋白變構調節劑(CpAM)。目前暫時未見有關該葯的更多公開資訊。
QL-0A6a
QL-0A6a 是齊魯葯業研發的一款衣殼抑製劑,在HepG.2 .15 細胞實驗中,低濃度的QL-0A6A可干擾HBV的衣殼裝配。QL-0A6A對不同基因型的HBV均有抑製作用,與核苷(酸)類似物聯用也表現出對HBV的複製呈現聯合抑製作用。QL-0A6A對核苷(酸)類似物耐葯的HBV突變體也具有活性。在HDI模型中QL-0A6A對HBV複製的抑製作用呈濃度依賴性。在FRG小鼠模型中,QL-0A6A使血漿 HBV DNA 最多下降了3 .71 log,肝內HBV DNA也明顯降低,通過qPCR 和Southern blot 檢測發現。在FRG研究中QL-0A6A的抗HBV活性比替諾福韋要高。
QL-007
QL-007 也是齊魯葯業研發的一款衣殼抑製劑,據CDE數據顯示該葯現已進入I期臨床研究。目前暫時未見有關該葯的更多公開資訊。
GLP-26
GLP-26 是美國埃默裡大學(Emory University)研發的一款衣殼抑製劑類,之前的EASL上關於GLP-26的臨床前研究顯示其良好的抗病毒效用,以及其與現有抗病毒藥物的聯合用藥效果,現在仍處於臨床前研究階段。目前暫時未見有關該葯的更多公開資訊。
EP-027367
EP-027367 是 Enanta 公司研發的一款新型衣殼抑製劑。在今年的歐洲肝病學會年會上上發布的研究結果顯示,體外試驗中EP-027367可通過調節HBV衣殼裝配並阻斷病毒pgRNA衣殼化。在HepG2.2.15,HepAD38和HepDE19細胞中分別以EC 50s 20,24和40nM 抑製 HBV rcDNA 產生作用。對HBV基因型A-H均有活性,效力範圍從7到50nM,並且不受已知核苷(酸)類似物耐藥性變異的影響。
EP-027367與其他HBV抑製劑的聯合使用在體外顯示出增效和協同抗病毒活性。此外,EP-027367可以以亞微摩爾的濃度通過抑製新cccDNA的形成來防止易感細胞系的從頭感染。在人肝臟嵌合體小鼠模型中,以 50,100和200mg / kg BID 口服給葯28天的EP-027367分別使HBV DNA水準從基線分別降低2.2 , 2.7 和 3.0 log。
5.HBsAg抑製劑(HBsAgInhibitors)
HBsAg 抑製劑主要通過干擾B肝表面抗原的產生來實現抗B肝病毒目的。該類藥物目前的代表藥物是核酸聚合物(NAPs)類藥物,代表藥物有 REP 2139 和 REP 2165,這兩款藥物均為加拿大公司 Replicor 研發,目前已經在Phase II 期臨床研究。目前的研究發現NAPs 具有清除循環中乙型肝炎表面抗原(HBsAg)的獨特能力,其通過阻止HBsAg 從感染的肝細胞分泌,潛在地干擾亞病毒顆粒的釋放。此外,還有 Roche 公司的RO7020322(RG7834) 。
REP 2139 & REP 2165
已公布的2期臨床研究( REP 301 研究,NCT02233075) 顯示 REP 2139 跟 pegIFN 聯合用藥使 5/12名慢B肝患者獲得功能性控制,並在撤掉所有抗病毒藥物後5名患者的HBV維持著功能性清除(HBsAg < LLOQ, HBV DNA < LLOQ)。
REP 301研究的24周隨訪結束時,5名實現HBV感染功能性控制的患者仍然有4名持續維持著功能性控制。第五位患者的 HBV感染仍然得到很好的控制(HBV DNA隨後進行的REP 401研究(NCT02565719)主要是評估 REP 2139-Mg(臨床)或 REP 2165-Mg 聯合富馬酸替諾福韋二吡呋酯(TDF)和聚乙二醇化干擾素α-2a(pegIFN)治療慢性HBeAg陰性HBV感染的安全性和有效性。在該研究中40名患者隨機(1:1)進入實驗組(TDF 48周,pegIFN 和 REP 2139-Mg / REP 2165-Mg)或對照組(48周TDF +pegIFN)。24 周治療後,由於HBsAg 反應較差,所有對照組患者均進行了48周的實驗治療。
伴隨 REP2139-Mg / REP 2165-Mg 暴露,在38/40例患者中觀察到轉氨酶升高。這些升高均自行緩解且無癥狀並與治療期間血清 HBsAg 的降低相關。實驗治療期間,HBsAg減少如下:在36/40患者中從基線開始> 1log,在28/40患者中<1IU / mL,在24/40患者中<0.05IU / mL。
HBsAg 血清學轉換(> 10 mIU / mL)發生在24/40例患者中,12/40患者的滴度> 1000 mIU / mL,10/40患者的滴度> 10,000 mIU / mL 。在完成治療且≤24周隨訪的患者中,HBV感染的功能性控制目前持續維持著。
對於≥24周隨訪的功能性控制患者,20/26 患者 HBsAg 目前≤10IU / mL,14/26患者≤0.05IU / mL(LLOQ)。ALT 和 AST 在25/26例患者中正常化(<50 U / L)。此外,目前在 21/26 例患者中觀察到治療結束時肝臟硬度中位數下降,16/26例患者正常(<7 kPa),肝功能正常化和肝硬化中位數下降也表明這些患者纖維化的逆轉。
對於研究中觀察到一小部分患者在 REP 2139 治療過程中的 HBsAg 降低只有非常小的滴度(< 1 log),研究人員後續進行的研究發現B肝病毒完整的前S / S ORF氨基酸序列對REP 2139-Ca 治療的反應沒有直接影響。
RG7834
RG7834 是一款由Roche公司研發的用於慢B肝治療的新葯,屬於HBsAg抑製劑類藥物。不過據說因為藥物的神經毒性公司已經放棄了改款藥物的研究。
2017年發表的研究結果顯示,在HBV自然感染試驗和HBV感染的尿激酶型纖溶酶原激活因子/重症聯合免疫缺陷人源化小鼠模型中,單用RG7834或RG7834和恩替卡韋聯合應用研究顯示。核苷(酸)類似物可以有效降低病毒血清學水準,但不能有效降低HBV抗原表達,而RG7834的作用特徵與核苷(酸)類似物不同,除了可以降低病毒水準,還可以顯著降低包括HBsAg等病毒蛋白的水準。表達水準分析表明,應用RG7834治療可以使HBV mRNAs水準快速選擇性下降。
在HBV感染的人源化小鼠模型中,恩替卡韋治療對HBsAg水準無顯著影響,與之相比,RG7834口服治療可以使HBsAg水準平均下降1.09 log;此外,聯合應用RG7834、恩替卡韋和聚乙二醇干擾素-α,可以使人源化小鼠的HBV DNA和HBsAg水準均顯著下降。
6.反義分子(AntisenseMolecules)
此類藥物通過與病毒mRNA結合阻止其轉變為病毒蛋白從而抑製病毒複製。跟RNAi療法藥物作用於B肝病毒的作用機理類似。代表藥物有 Ionis 跟 GSK 開發的 IONIS-HBV-LRx(GSK33389404),IONIS-HBVRx(GSK3228836)。美國斯克利普斯研究所(TSRI)在《Journal of Hepatology 》上曾發表過一篇有關反義寡核苷酸用於B肝的研究[2]。
IONIS-HBV-LRx(GSK33389404)
IONIS-HBV-LRx 即是以前的 IONIS-GSK6-LRx,是 Ionis 公司跟 GSK公司合作研發的一款使用配體共軛反義(LICA)技術的2.0代產品藥物,設計用於降低跟B肝病毒感染和複製相關的病毒蛋白,包括B肝表面抗原(HBsAg)。IONIS-HBV-LRx 是使用 Ionis 公司創新性技術配體共軛反義(LICA)技術的首款抗病毒感染藥物,其旨在通過增強靶向組織的藥物遞送來增加藥物效力。
在2017年3月份,Ionis 公司合作夥伴 GSK 已經啟動了在研新葯 IONIS-HBV-LRx 的Phase 2 期臨床研究,該研究是在未經治的慢B肝患者中進行的。而 Ionis 公司也曾於2016年1月份完成了 IONIS-HBV-LRx 的 Phase 1期臨床試驗,該1期臨床主要評估單劑量和多劑量 IONIS-HBV-LRx 在健康志願者中的安全性、耐受性和葯代動力學。
目前未見有關該葯的詳細試驗數據公布。
IONIS-HBVRx(GSK3228836)
IONIS-HBVRx 也是一種反義藥物,是配體共軛反義(LICA)技術的2.0代產品,設計用於降低跟B肝病毒感染和複製相關的病毒蛋白,包括B肝表面抗原(HBsAg)。
在2017年3月份,Ionis 公司合作夥伴GSK 已經啟動了在研新葯 IONIS-HBVRx 的 Phase 2 期臨床研究,該研究是在未經治的慢B肝患者中進行的。而 Ionis 公司也曾於2016年1月份完成了 IONIS-HBVRx 的 Phase 1期臨床試驗,該1期臨床主要評估單劑量和多劑量IONIS-HBVRx 在健康志願者中的安全性、耐受性和葯代動力學。
目前未見有關該葯的詳細試驗數據公布。
7.核糖核酸酶H抑製劑(Ribonuclease H Inhibitors)
核糖核酸酶H是B肝病毒複製過程中一種重要的酶,是B肝病毒多聚酶基因編碼的4個功能域之一,該蛋白具有降解DNA-RNA雜交體中RNA的活性,在HBV 逆轉錄過程中發揮重要作用。針對該酶是開發治療B肝藥物的一個有吸引力的靶點,聖路易斯大學研究人員曾在Antiviral Research雜誌中報告了 RNaseH 酶的第一次完整的生化分析研究結果,這是是篩選新藥物的關鍵。此後,他們還在 Antimicrobial Agents and Chemotherapy雜誌上報導了 RNaseH 抑製劑跟現有主要的抗B肝病毒藥物聯合用藥的研究結果,表明該葯跟現有藥物聯合用藥具有協同作用。
該類藥物目前查到的較少,Lomonosova E 等在 Antiviral Res 雜誌上報導了α-羥托吡酮類化合物用於抑製B肝病毒複製的體外研究結果(Efficacy and cytotoxicity in cell culture ofnovel α-hydroxytropoloneinhibitors of Hepatitis B virus ribonuclease H.)。還有 Arbutus 公司也有一款處在臨床前研究階段針對核糖核酸酶H的在研B肝新葯ARB-452,不過目前還未見更多詳細試驗數據公布。
8.治療性B肝疫苗
治療性疫苗是指在已感染病原微生物或已患有某些疾病的機體中,通過誘導特異性的免疫應答,達到治療或防止疾病惡化的天然、人工合成或用基因重組技術表達的產品或製品屬於特異性免主動疫療法。治療性B肝疫苗是針對慢性乙型肝炎患者或HBV 攜帶者,通過不同途徑呈遞B肝抗原,打破機體的免疫耐受,有效誘導免疫應答,達到清除B肝病毒目的。治療性B肝疫苗主要分為基因工程蛋白疫苗、DNA疫苗、DC疫苗等。
目前全球在研的治療性B肝疫苗有較多,其中代表性的有 AiCuris 的 AIC 649,Inovio的INO-1800,Ichor 的 HB-110,Transgene 的 TG1050,Altimmune 的 HepTcell,TomegaVax 的 HBV (TomegaVax),GeoVax Labs 的 HBV,Vical 的 VR-CHB01。
AIC 649
AIC 649 是一款 AiCuris 公司研發的一種滅活的羊副痘病毒(iPPVO)顆粒製劑,具有獨特的免疫學活性包括調節細胞因子釋放和激活T細胞應答。早起研究顯示,小鼠經靜脈給予單劑量 AIC-649 刺激了細胞因子的釋放,包括干擾素γ和α、TNF-α、單核細胞趨化蛋白1 (MCP-1) 及白介素-6 (IL-6)。此外,在轉基因小鼠模型中,AIC-649 降低 HBV 病毒載量的作用與替諾福韋相仿。使用這一策略的更多證據來自替代 HBV 的旱獺肝炎病毒(WHV),感染旱獺使用 AIC-649 後,WHV 表面抗原水準明顯降低。
已公布的部分 Phase1 期單遞增劑量臨床試驗結果顯示 AIC649安全性和耐受性良好,沒有劑量限制性毒性,並且最大耐受劑量未達到施用的最高劑量。
INO-1800
INO-1800是Inovio公司研發的一種治療性B肝疫苗,臨床前研究數據表明,該疫苗能夠產生強大的T細胞和抗體反應,並在小鼠模型中引發了針對性的肝細胞清除。已公布的Phase 1 期臨床結果顯示其具有良好的安全性,耐受性並且產生病毒特異性T細胞,包括CD8 +殺傷T細胞,達到 Phase1 期臨床研究的目標。
目前該疫苗仍在繼續進行臨床試驗。
HB-110
mHB-110 是一款新型 DNA 疫苗,前期在BALB/c 或 HBV轉基因小鼠研究中,HB-110具有免疫原性並檢測到T細胞和抗體應答產生。
而在韓國慢B肝患者中進行的Phase 1期臨床研究結果顯示,mHB-110 誘導的T細胞核抗體應答比在小鼠中的應答更高。跟阿德福韋酯聯用的慢B肝患者中沒有觀察到不良反應事件。HBV特異性T細胞應答在中高劑量組的部分慢B肝患者中出現,對ALT正常化轉歸和 HBeAg 血清學轉換也表現出積極作用。接受高劑量 HB-110 用藥的一例慢B肝患者在疫苗接種期間出現 HBeAg 血清學轉換,可能跟疫苗誘導的T細胞應答但沒有ALT升高有關。 HB-110在慢B肝患者中安全性耐受性良好,相較於在動物模型中的結果,HB-110 在韓國患者中誘導的HBV 特異性T細胞應答和HBeAg 血清學轉換要較在白人人中弱。
目前該款疫苗暫未有更進一步的研發進展資訊公布。
JNJ-64300535
JNJ-64300535 是一款 Janssen 公司研發的用於慢B肝治療的研究性DNA疫苗,該款疫苗採用TriGrid藥物遞送系統進行藥物遞送。目前該款治療性B肝疫苗已經開始進行人體試驗,並於今年6月完成人體用藥工作,
目前該款疫苗暫未有更多臨床研究資訊公布。
TG1050
TG1050 是Transgene 公司研發的一款基於腺病毒的治療性B肝疫苗,能編碼一種獨特融合蛋白的複製缺陷型腺病毒5型,該融合蛋白是由截短的HBV核心蛋白、修飾的HBV聚合酶和兩個HBV包膜區組成。
在HBV初始感染和HBV持續感染的小鼠模型中,注射TG1050既誘導脾臟的又誘導肝內的功能性T淋巴細胞產生,並釋放細胞因子和具有細胞毒作用,同時循環血中病毒(活躍或複製的)指標顯著下降。
在使用NUC控制良好的慢B肝患者中完成的phase 1b 期研究顯示,TG1050 耐受性良好;主要藥物相關不良事件(AEs)為1級或2級注射部位反應,沒有ALT升高,沒有SAE,也沒有觀察到免疫相關AE的跡象。患者接種疫苗後出現HBV特異性T細胞應答,多名患者出現至少1種甚至多種針對疫苗抗原的應答。試驗結果證實了TG1050的免疫原性以及其破壞CHB免疫耐受的能力,同時改善了對多種HBV抗原(包括ENV)的T細胞應答。
目前該治療性疫苗已獲得國內葯監部門批準進行臨床試驗,國內名稱為治療用乙型肝炎腺病毒注射液(T101)。
HepTcell
HepTcell 是 Altimmune 公司開發的一款產品,已進行的 Phase 1b 期研究結果表明,在所有測試劑量下 HepTCell 都具有良好的耐受性,但非盲T細胞免疫原性(unblinded T-cell immunogenicity)結果不能確定。根據研究方案,研究將對受試者進行完整的6個月隨訪,不過從官方發布的結果看他們對該款疫苗的前景似乎不太樂觀。
HBV (TomegaVax)
HBV(TomegaVax)是TomegaVax公司的產品,目前還處在臨床前研究階段,未見更多詳細資訊公布。
VR-CHB01
VR-CHB01 是Vical公司開發的一款產品,目前還處在臨床前研究階段,未見更多詳細資訊公布。
Nasvac
Nasvac 是古巴基因工程與生物技術中心(CIGB)研發的一款治療性B肝疫苗,含B肝表面抗原(HBsAg) 和B肝核心抗原(HBcAg)。
首批用藥(phase I期臨床)的6名慢B肝患者停葯5年的隨訪結果顯示,其中3名HBeAg陽性患者的HBeAg已經消失,2名患者出現HBeAg血清學轉換出現anti-HBeAg。6名患者中有5名患者的病毒載量下降到檢測下限,其中有2名患者出現 HBsAg 血清學轉換。ALT升高到2倍正常值上限以上的僅在HBeAg陽性患者中觀察到且跟HBeAg消失相關。在隨訪期間,所有患者均未出現肝硬化或中度肝纖維化(通過Fibroscan評估<7.8 KPa)。由於隨訪期間肝功能持續正常以及沒有出現達到需要治療的標準,因此不需要任何其他藥物乾預。
法國生物科技公司 ABIVAX 曾拿著該款治療性B肝疫苗在亞太地區的8個國家和地區(澳大利亞,紐西蘭,台灣,香港,泰國,新加坡,韓國)進行了Phase IIb/III 期臨床試驗。不過很遺憾,試驗進行至中途由於病毒逃逸導致患者退出率過高,研究的首要研究終點無法實現,公司經研究分析後放棄了該款治療性B肝疫苗的臨床研發。
最近的2018AASLD上,研究人員發表了一項該藥物的改良版在日本進行的臨床試驗結果:23名使用NUCs 的HBV患者(平均ALT:19(16-27)U / L,平均HBsAg:436(229-1853) IU / mL))和31名未使用NUCs的HBV患者(平均ALT:21(16-27)U / L,平均HBsAg:1370(101-3469)IU / mL)),每2周僅通過鼻腔給葯 10次。研究評估治療結束時(EOT)和EOT後6個月的數據。
截止研究結果發表,已有12名wNUC患者和5名w / oNUC患者完成6個月隨訪。在11/12名(91.7%)wNUC患者和5/5名(100%)w / oNUC患者中觀察到HBsAg的減少。wNUCs 患者的 HBsAg 減少量為23.5%(平均值),w / oNUCs患者為44.1%。在12名(25%)wNUC患者中有3名檢測到HBsAg抗體(抗-HBs),在5名(40%)w / oNUC患者中2名檢測到抗體。據最新數據顯示2名w /oNUCs患者和1名患者wNUCs患者已經實現了 HBsAg 的清除和獲得抗HBs 且HBV-DNA持續陰轉。
目前該款疫苗的臨床研究仍在繼續。
9.靶向先天免疫防禦途徑(InnateImmune Defense Pathway)藥物
該類藥物通過激活先天免疫應答達到抗病毒作用,代表藥物有 Inarigivir (SB9200)、GS9688、RG7854和JNJ‐4964(AL‐034/TQ‐A3334)等。
RG7795
RG7795(以前的ANA773)是一種抗病毒藥物候選藥物,是一種研究性可口服用藥的小分子化合物,通過肝炎中的Toll樣受體7(TLR7)途徑起作用,是isatoribine前葯,Anadys Pharmaceuticals 在 2011 年被 Roche 收購時該葯正在開發中。 TLR7激動劑引起抗病毒細胞因子的產生和免疫細胞的活化/成熟,具有增強免疫應答的潛力。
臨床前數據顯示,ANA773的活性代謝物通過誘導細胞因子分泌,腫瘤細胞的細胞溶解和增強的抗體依賴性細胞毒性(ADCC)來促進自然殺傷(NK)細胞介導的抗腫瘤反應。
至2015年已進入II期臨床試驗,不過目前未見更多公開資訊。
RG7854
RG7854 是 Roche 公司的一款Toll樣受體7(TLR7)激動劑,目前處在Phase I期臨床,不過目前未見更多公開資訊。
GS9688
GS9688 是Gilead公司的一款選擇性小分子toll樣受體8(TLR8)激動劑,在慢B肝土撥鼠模型中, GS-9688 誘導實現了更長時間的血清 WHV DNA 和 WHsAg 抑製, 減少肝內cccDNA並誘導產生可檢測水準的anti-WHsAg 。
已公布在健康志願者中進行的1a期研究結果顯示,口服 GS-9688 誘導血清免疫調節(如IL-12p70)和抗病毒(如IFN-g和TNF-α)細胞因子,以及多種趨化因子和急性期蛋白水準呈現劑量依賴性增加。細胞因子和趨化因子水準在給葯後2-4小時達到峰值,並在給葯後24小時恢復到接近基線。急性期蛋白C-反應蛋白(CRP)和血清澱粉樣蛋白A(SAA)的誘導顯示出較慢的動力學,在給葯後24小時測量到最高水準。除了這些可溶性因子外,口服GS-9688還增加了NK和粘膜相關不變T(MAIT)細胞表達早期活化標記物CD69 的表達頻率。
目前該葯的臨床研究仍在繼續。
Inarigivir (SB9200)
Inarigivir(SB9200) 是一款由 SpringBank Pharmaceuticals 公司開發一款新葯,是一種小分子二核苷酸口服有效的HBV抗病毒藥物,具有直接作用和免疫調節活性,刺激宿主固有的抗病毒應答。與細胞質模式識別受體視黃酸誘導基因(RIG-I)結合以增強RIG-I與HBV前基因組RNA的5"-ε區域的結合,通過置換 HBV Pol 或阻止 pgRNA 衣殼化和複製複合物的組裝。
目前該葯已經進行 Phase 2 期臨床研究,低劑量組 25mg 、 50mg劑量組顯示該藥用葯12周後,轉換為每日300mg的替諾福韋(TDF)再用藥12周能使HBV DNA 、HBsAg 和HBV RNA 顯著降低甚至低於檢測下限,部分患者出現抗-HBs抗體及治療性ALT升高,研究中還觀察到HBeAg陰性患者比HBeAg陽性患者具有更強的抗病毒應答。研究過程中inarigivir 的耐受性良好,沒有觀察到嚴重不良反應事件。因治療而出現的不良反應事件均為輕度至中度,沒有觀察到干擾素樣副作用或臨床或3級以上的生化學事件。
Gilead 公司正在實施 inarigivir 聯合替諾福韋艾拉酚胺(TAF)的 Phase2 期臨床研究,該研究是在未經治的慢B肝患者中進行的。該研究的新第二隊列將評估200mg inarigivir與替諾福韋艾拉酚胺共同給葯,接受 200mg 劑量的 inarigivir 安全性的獨立監管評估。此外,還增加了一個新的第三個隊列來檢查 100mg 的 inarigivir 用於目前已用核苷(酸)類似物(「Nuc抑製」群體)治療的慢B肝患者的效用。
待該研究全部完成後,Spring Bank 將會在 2019 年初將 inarigivir 開發推進到多個計劃的 Phase 2b / 3 期研究。計劃的臨床試驗包括:1)inarigivir單葯治療作為Nuc抑製患者(「抑製和休克」)的附加藥物;2)給停止Nuc治療的患者(」停止和休克「)予inarigivir 單葯治療。
另外,SpringBank除將 inarigivir 推進到 Phase 2b / 3 期計劃之外,還計劃在未經治的慢B肝患者中開展一項關於 SB 9225 的 Phase 2b 期臨床試驗,SB 9225是一種由inarigivir 和替諾福韋(TDF)混合劑量組成的藥物。公司還將繼續探索合作,包括針對HBsAg 的 siRNA化合物,以及其他抗病毒和免疫調節機制藥物聯合用藥研究合作。
JNJ‐4964(AL‐034/TQ‐A3334)
JNJ‐4964是 Janssen 公司研發的一款用於治療慢性乙型肝炎(CHB)的口服Toll樣受體7(TLR7)激動劑,可能在恢復對HBV的免疫應答中起重要作用。據一項已發表的在AAV / HBV動物模型中評估JNJ-4964恢復抗HBV免疫應答能力的臨床前研究結果顯示,JNJ-4964 在治療12周的 AAV /HBV 小鼠中顯示出有效的抗HBV活性。所有動物在開始治療14天后都檢測不到 HBV-DNA 和 HBsAg ,且無 ALT 升高。在隨訪結束前未觀察到HBV DNA和HBsAg的反彈。在治療開始後21天至隨訪結束時觀察到血清學轉化(HBsAg低於檢測極限並具有可檢測的抗-HBsAg抗體)。
在隨訪結束時,肝臟 HBV-DNA 和 HBV-RNA 水準分別下降了 1.17 log10 和0.7log10。在第16周(最後一次給葯後4周),一半動物的肝臟中HBcAg表達下降,HBsAg檢測不到。在治療結束和隨訪結束時觀察到可檢測水準的針對錶面抗原的T細胞和B細胞應答,表明在JNJ-4964處理的小鼠中存在持續的T和B細胞免疫。
10.宿主靶向途徑(HostActing Pathway)藥物:誘導程式性細胞死亡(細胞凋亡)的化合物
APG-1387
APG-1387是我國領先的原創新葯研發公司亞盛醫藥自主設計開發的、具有全球知識產權的新一代凋亡蛋白抑製因子(IAP)高效特異性抑製劑,主要通過模擬內源性Smac分子降解IAPs來誘導和加速細胞凋亡的進程。
由南方醫院肝病中心張小勇教授課題組完成的臨床前研究發現,慢性B肝患者肝內IAPs分子表達上調,導致HBV感染的肝細胞發生免疫逃避,不能被特異性T細胞殺傷。APG-1387治療可有效抑製肝細胞中的IAPs表達,促進病毒特異性T細胞介導的HBV DNA和HBV表面抗原的消除,從而治癒慢性HBV感染。IAP抑製劑用於治療B肝病毒感染的優勢在於,依靠特異性T細胞的識別能力,能優先殺死感染細胞而不影響健康細胞。
該葯目前已獲得食品藥品監督管理局(CFDA)核發的新型小分子IAP抑製劑APG-1387針對乙型肝炎適應症的新葯臨床批件。
CRV 431 (CPI 431-32)
CRV431是 ContraVir 公司研發的一款環孢菌素A(CsA)的非免疫抑製類似物(親環蛋白抑製劑),其主要生化作用是抑製在蛋白質摺疊中起關鍵作用的親環蛋白異構酶。其他病毒如HIV-1和HCV同樣使用親環蛋白進行複製。 CRV431在實驗模型中通過減少多種感染標誌物(包括HBV DNA,HBsAg,HBeAg和細胞對HBV的攝取)顯示了其有望成為補充當前乙型肝炎治療的潛力。已有研究表明,CRV431還具有抗纖維化活性,可以進一步抑製患者肝臟疾病的進展,此外,在NASH鼠模型中,CRV431減少了動物模型中纖維化的進展,並且還減少了肝細胞癌(HCC)模型中肝腫瘤的數量和縮小了腫瘤的大小。
該葯已經進行 Phase1 期臨床研究,公布的第一隊列數據顯示,CRV431在安全性和耐受性方面均良好。第二隊列觀察到的研究結果跟第一隊列的結果相一致,顯示其安全性和耐受性均良好,並在葯代動力學(PK)上的表現跟在健康成年志願者中的單劑量用藥的表現相一致。
CRV431的Phase 1期臨床研究第一部分將評估CRV431 在健康志願者中單劑量給葯的安全性,耐受性和葯代動力學(PK)特徵。研究的第二部分將是在穩定的HBV患者中使用CRV431聯合Viread?的單劑量藥物 - 藥物相互作用初步研究。研究的第三部分將評估穩定HBV患者使用 CRV431 與 Viread? 聯合用藥的安全性,耐受性,PK和抗病毒效用的初步信號以及對臨床相關生物標誌物的初步影響。
NJK14047
NJK14047是一種選擇性的p38 MAPK抑製劑,是韓國慶熙大學研究人員合成的一系列聯苯醯胺類藥物之一。測試研究結果顯示,NJK14047可有效地抑製HBV基因轉染細胞和HBV感染的表達牛磺膽酸鈉共同轉運多肽人肝癌細胞的HBV抗原和HBV顆粒分泌。
此外,研究人員還發現NJK14047用藥後HBV攜帶細胞中HBV的前基因組RNA(pgRNA)和共價閉合環狀DNA(cccDNA)均出現顯著降低,表明其具有抑製HBV複製的能力。
目前暫時沒有該藥物的進一步研究資訊。
11.基因編輯類
基因編輯是指對DNA核苷酸序列進行定點修飾(刪除和插入等操作)的一項技術,該技術可精確剪斷靶DNA片段並插入新的基因片段,既可以模擬基因的自然突變,又可以修改編輯原有基因組,真正實現「編輯基因」。目前國內外使用基因編輯技術進行的非人體研究非常多,已將該技術進行臨床試驗的公開研究屈指可數,並且這些公開的臨床試驗都不是慢B肝治療領域,據Clinicaltrials.gov登記在冊的共有10項臨床試驗,其中有1項已經終止研究,餘下9項研究中有6項來自中國。
而目前暫時未見公開報導使用該技術用於慢B肝治療的臨床試驗研究。據悉吉列德科學公司已經進軍基因編輯用於慢B肝治療研究領域,國內有公司還有望引進吉列德的該技術在國內進行臨床研究。
12.其它類
GC1102
GC1102 是一款韓國 Green Cross 公司研發的單克隆抗體(重組人乙型肝炎免疫球蛋白)藥物,該葯有望通過降低血液HBsAg水準來改善持續的病毒學應答,從而提高治療效果。
已發表的研究結果顯示,血清HBsAg≤1,000IU/ mL的慢B肝患者單劑量或多劑量給葯(80,000 IU,120,000 IU,180,000 IU和240,000 IU)耐受性和安全性良好,未發生劑量限制性毒性。受試對象每次給葯者HBsAg滴度均顯著下降,然而停葯28天后HBsAg滴度開始反彈,經歷HBsAg消失的受試者除外。
目前該葯已經進入Phase2/3期臨床。
EYP001
EYP001是一款 Enyo Pharma 公司研發的類法尼醇X受體(farnesoidX receptor,FXR)激動劑。體外研究結果顯示 EYP001 能抑製HBV顆粒的釋放,單藥用葯能抑製病毒蛋白(HBsAg 和 HBeAg)產生,降低cccDNA和pgRNA。
已經完成的 1a期臨床結果顯示該葯安全性和耐受性良好,沒有治療相關的停葯或嚴重的不良事件(SAE)。
在Ib期研究中,慢B肝患者單用該葯或跟聚乙二醇干擾素Peg-IFNα2a聯合用藥,每日一次口服治療4周。EYP001 安全性和耐受性良好,最常見的治療期間發生的不良事件(TEAE)為胃腸道失調。這些TEAE均為短暫性,程度為輕度至中度。在所有EYP001每日一次(QD)劑量組中,只有10%的患者出現輕度自限性瘙癢,沒有觀察到LDL-C水準升高。沒有觀察到脫靶效應,沒有發生嚴重不良反應或嚴重的意料之外的嚴重不良反應。EYP001 單葯或聯合用藥在 HBeAg 陰性和HBeAg 陽性慢B肝患者中,對幾個B肝病毒參數表現出一致的抗病毒作用,包括:HBV病毒載量、HBV RNA、HBcrAg、HBsAg。
目前該葯已經進入II期臨床開發。
此外,一些新興的熱門治療技術或藥物也被應用於慢B肝的臨床前/臨床研究,如CAR-T免疫療法、PD-1/L1抑製劑等,並且也有部分相應的研究/臨床數據公布,但觀察到的臨床效果有限,此處不展開,感興趣的可以去搜索相關文獻了解。
討論(個人觀點)
慢B肝治療已經由干擾素和核苷(酸)類似物統治了20多年,他們或仍將統治很長的一個時期。雖然現階段針對慢B肝治療的在研藥物非常多,不少藥物也進入臨床試驗,然而截止目前尚未發現有任何一款在研藥物在臨床試驗中表現出徹底治癒慢B肝潛能,是否跟臨床試驗受試對象數量較少、當前研究中監測的生物標誌物以及藥物本身的效用等有關尚有待明確。
由於慢B肝的難治癒性問題,近些年,國內外均對慢B肝的治癒概念進行不少探討以期逐步實現徹底治癒目標。國內2015版慢B肝指南提出了「慢B肝臨床治癒」概念,即停止治療後血清HBV DNA 持續低於檢測下限且HBsAg陰轉或伴隨抗HBs陽轉、ALT正常、肝組織學病變輕微或無病變。在2017年的B肝治療終點工作組(Hepatitis B Treatment Endpoints Workshop,該工作組由AASLD和EASL聯合成立)會議上也提出了三個慢B肝治癒定義標準,但還沒完全達成共識,分別是:1)完全治癒(complete sterilizing cure):血清中無法檢測到HBsAg,根除HBV DNA,包括肝內 cccDNA 和整合 HBV DNA;2)功能性治癒(functional cure):在完成有限治療後,血清中 HBsAg 和 HBV DNA 水準持續處於檢測下限水準,伴隨或不伴隨乙型肝炎表面抗體(抗HBs)的血清學轉換,肝功能恢復正常,肝細胞肝癌風險降低(還討論了幾個功能性治癒的指標,包括cccDNA轉錄完全停止,消除cccDNA,完全解決肝損傷,消除HCC風險);3)部分性治癒(partial cure):在完成有限治療後,HBsAg處於可檢測水準,但 HBV DNA 持續處於檢測下限水準。
顯然,在慢B肝徹底治癒尚無法在短期內立即實現的情況下唯有採取分步實現策略。針對當前慢B肝一旦用藥後便需終身用藥的無奈,現已逐漸達成共識——經過一定時間治療後可安全停葯且不發生病毒反彈(臨床治癒/功能性治癒)!不難看出,新治癒概念對HBsAg陰轉甚至出現抗HBs陽轉提出了要求,這是現有核苷(酸)類似物無法達到的靶標。在研藥物在臨床試驗監測過程中多將HBsAg作為監測效用的生物標誌物之一,代表藥物有RNAi療法藥物ARO-HBV、ARB-1467,衣殼抑製劑GLS4,核酸聚合物(NAPs)REP 2139 、 REP 2165,治療性B肝疫苗Nasvac、免疫調節劑Inarigivir (SB9200)等。實際臨床試驗中也觀察到不少藥物的確對HBsAg 的降低效果顯著,部分藥物單葯或跟現有批準藥物聯合用藥甚至可將部分患者的HBsAg降至低於檢測下限水準甚至出現抗HBs陽轉,一些患者在停葯的隨訪期間也沒有出現病毒的反彈,但最終結果仍有待更長期觀察。隨著技術進步,不斷誕生作用更強新葯,在可預見的不久,經過固定療程治療後安全停葯且不發生病毒反彈這一目標可期。
不少在研藥物在實驗模型測試中降低HBV標誌物如HBV DNA、HBV RNA、HBsAg和HBeAg等的表現令人滿意,可一旦進入實際臨床測試卻往往無法達到臨床前觀測到的效果。跟現有HBV感染動物模型有關,目前絕大多數HBV感染動物模型尚無法完全模擬HBV感染人體複雜多變的環境,一些如土撥鼠模型、鴨模型、小鼠模型、樹鼩模型、猴模型和豬模型等只能部分模擬人體環境,如HBV的高水準複製、HBV感染後的免疫、無法持續性出現病毒複製和表達HBV基因等這類問題目前尚未能在一種動物模型中進行全面的模擬,而一些大致可以模擬人體感染HBV環境的動物模型又多因倫理和成本高昂等問題難被大規模進行藥物測試,因此,更好的HBV 感染動物模型的研究仍有待突破,目前的人工智慧應用於生物醫藥的研發測試能否助一臂之力有待觀察。只有能夠比較容易的實現在動物模型中模擬人體感染HBV 的狀態才更有可能測試出在人體臨床用藥中可等效於動物模型中觀測到的藥物效用。
現有標誌物如HBV DNA、HBeAg或還無法完全滿足臨床需求,以至於某些慢B肝患者停葯後發生病毒反彈的情況經常發生,發現和開發滿足臨床需求的新生標誌物也是當前的一大問題。如今的新葯研發過程中已將一些新興HBV生物標誌物如HBV RNA、cccDNA、HBV pgRNA、抗-HBc、HBcrAg等納入到新葯試驗過程的監測,某些藥物也表現出對某個或某幾個標誌物具有一定的作用,而將這些新生標誌物完全應用於實際臨床的時機還未完全成熟,存在的問題如這些新生標誌物對實驗室環境要求過高,許多醫院實驗室/檢驗科環境完全沒辦法開展;缺乏便捷可用的生物標誌物檢測試劑;這些新生標誌物對臨床的指導臨床意義還無法完全證實等等,這些都是將這些生物標誌物應用於實際臨床或藥物研究面臨的問題,這都有待更多、更大規模的臨床研究加以解決。
展望
綜上,隨著對B肝病毒在人體作用機制的進一步了解,針對B肝病毒整個生命周期中各個靶點的藥物也逐漸地被開發出來,這也是我們能看到全球竟有如此多針對B肝的在研新葯原因。從目前能接觸到的公開在研新葯數據看來,或許對慢B肝的基礎理論研究依然有待更進一步。目前理論研究認為,藥物若能徹底清除肝細胞細胞核中的cccDNA應該可以真正實現慢B肝的徹底治癒,從當前已公布的在研藥物研究資訊似乎還未能發現有任何一款藥物能夠達到這一目標。然這一概念是否真的可行有待實際臨床研究加以證實,而若想對該概念進行徹底的印證,基礎理論研究、動物模型研究、藥物研發測試、檢測新型生物標誌物的實驗室環境、檢測標誌物的生物試劑等這些條件都有待突破。