概述
胃癌是嚴重威脅我國人民生命健康的重大疾病之一,據國家癌症中心報告,2015 年我國新發胃癌67.91 萬例,死亡49.80 萬例,其發病率和死亡率均高居惡性腫瘤的第二位。胃癌的轉歸和預後與其臨床分期密切相關。進展期胃癌患者根治性切除率低,生活品質差,其5 年腫瘤相關生存率不足30%,而早期胃癌患者預後較好,5 年生存率可達90%以上。
內鏡下切除術( Endoscopic resection) 已成為無淋巴結轉移風險的早期胃癌患者的首選治療方式。早期胃癌內鏡下切除主要包括: 內鏡下黏膜切除術( endoscopic mucosal resection,EMR) 和內鏡黏膜下剝離術( endoscopic submucosal dissection,ESD) ,並已在我國得到了廣泛應用。

定義與術語:
1、早期胃癌( early gastric cancer) :僅局限於胃黏膜層或黏膜下層,而不論有無淋巴結轉移的胃癌
2、整塊切除( en bloc resection) :病灶在內鏡下整塊切除,並獲得單塊標本
3、完全切除( complete resection /R0 resection) :水準和垂直切緣均為陰性的整塊切除
4、治癒性切除( curative resection) :病灶整塊切除,大小≤2 cm、垂直切緣與水準切緣陰性、無合併潰瘍且無脈管浸潤的分化型黏膜內癌
5、 相對治癒性切除( curative resection for expanded indications) :病灶整塊切除、垂直切緣與水準切緣陰性且無脈管浸潤的且滿足以下條件的早期胃癌:
( 1) 直徑> 2 cm,無潰瘍的分化型黏膜內癌
( 2) 直徑≤ 3 cm,可伴潰瘍的分化型黏膜內癌
( 3)直徑≤ 2 cm,無潰瘍的未分化型黏膜內癌
( 4) 直徑≤ 3 cm,分化型淺層黏膜下癌
6.非治癒性切除:指除治癒性切除和相對治癒性切除以外的早期胃癌的內鏡下切除
7.急性術中出血:指術中活動性滲血或噴射性出血且內鏡下止血困難,需中斷手術和( 或) 需輸血治療
8.遲發性出血:指內鏡治療術後出血且需要再次行內鏡下止血的情況。一般具備以下至少2 項者,即可診斷:
(1) 癥狀: 嘔血、黑便、頭暈等癥狀
(2) 內鏡治療前後血紅蛋白下降> 20 g /L
(3) 內鏡下治療前後血壓下降> 20 mmHg ( 1 mmHg =0.133 kPa) 或心率增加> 20 次/min
( 4) 胃鏡檢查示ESD 術後潰瘍出血
9. 局部複發( local recurrence) :指術後6 個月以上原切除部位以及周圍1 cm 內發現腫瘤病灶
10.殘留( residual) :指術後6 個月內原切除部位以及周圍1 cm 內病理髮現腫瘤病灶
11.同時性癌:指早期胃癌內鏡治療後12 個月內內鏡下發現新的病灶
12.異時性癌:指早期胃癌治療後,超過12 個月後發現新的病灶。大部分病灶多出現在胃原發病灶的鄰近部位,且組織病理類型相同
早期胃癌內鏡切除術前,建議行增強CT 等影像學檢查,明確有無區域淋巴結轉移及遠處轉移。
適應症:
1.絕對適應證:
(1) 無合併潰瘍的分化型黏膜內癌( cT1a)
(2) 病灶大小≤3 cm、有潰瘍的分化型黏膜內癌( cT1a)
(3) 胃黏膜高級別上皮內瘤變( high-grade gastric intraepithelial neoplasia,HGIN)
2.擴大適應證:病灶大小≤2 cm、無潰瘍的未分化型黏膜內癌( cT1a)
早期胃癌內鏡下切除適應證

注:cT1a(M):術前診斷為黏膜內癌;cT1b( SM):術前診斷為黏膜下癌;UL:潰瘍形成(瘢痕);* 不再限定病變大小。
內鏡下診斷性切除:
合併以下因素的早期胃癌或癌前病變的患者,可嘗試內鏡下診斷性切除:
(1) 伴有高危因素的低級別上皮內瘤變患者;
(2) 病變可疑黏膜下淺層浸潤,但內鏡下評估困難,內鏡切除或外科手術難以決策的患者;
(3) 適應證以外的早期胃癌,但一般狀況差,存在外科手術禁忌或拒絕外科手術的患者。
胃低級別上皮內瘤變( low-grade gastric intraepithelial neoplasia,LGIN) 的發病率約0.45% ~1.1%,癌變率約0.45% ~ 14.3%,每年約0.6% 的患者進展為胃癌。基於內鏡活檢下的病理診斷,與病變的真實性質並不是完全一致。
一項納入3303 例經術前活檢為LGIN 的患者的Meta 分析顯示,EMR 切除術後,16.7% 的患者病理提示HGIN,6.9% 的患者病理提示早期胃癌。活檢提示LGIN 的患者,伴有以下高危因素時,多出現病理更新,病變實際性質多為HGIN 或早期胃癌:
( 1) 病變大小> 2 cm
( 2) 表面發紅的凹陷型病變
( 3) 伴有結節樣改變的病變
因此,對於活檢提示的LGIN 且合併高危因素的患者,在獲得患者知情同意後,可嘗試進行內鏡下診斷性切除。非治癒性ESD切除的早期胃癌患者術後補充手術治療,而內鏡下黏膜下剝離等操作,並不增加淋巴結轉移風險,且對預後無明顯影響。
規範化的內鏡下切除方法:
1.EMR:是最早應用於早期胃癌的內鏡下治療方法。
EMR主要適用於無潰瘍性改變,且擬切除黏膜直徑≤2 cm 的病變。EMR治療早期胃癌的整塊切除率42.1%~77.7%,完全切除率41.0%~75.7%。
EMR 操作方法可歸為兩大類:
( 1) 非吸引法: 黏膜下注射-圈套切除法、黏膜下注射-預切-切除法等
( 2) 吸引法: 透明帽法和套扎器法
2.ESD:是在EMR基礎上發展起來的技術,已成為內鏡下治療早期胃癌的標準治療方式。
(1) 環周標記:通過染色或放大內鏡等,明確病變邊界,距離病變邊界約3 ~ 5 mm處,使用電刀或APC 等進行電凝標記,兩個標記點間隔約2 mm。
(2) 黏膜下注射:按先遠側後近側的順序,於病變周圍分多點行黏膜下注射,使黏膜層與固有肌層分離,病變充分抬舉。
(3) 環形切開:病變充分抬舉後,使用電刀沿標記點外約3 mm 處,環周切開病變黏膜。一般由遠端開始切開,過程中一旦出現出血,沖洗以明確出血點,後使用電刀或電凝鉗止血。
(4) 黏膜下剝離:使用電刀於病變下方行黏膜下剝離,直至完全剝離病變。過程中,及時進行黏膜下注射以保證黏膜下抬舉充分,同時電刀或電凝鉗及時處理暴露的血管。此外,在剝離過程中,採用鈦夾聯合絲線等牽引技巧,可有助於改善黏膜下剝離視野,降低ESD 操作難度,提高手術效率。
(5) 創面處理:使用電凝鉗或APC 等對創面,尤其是切緣周圍暴露血管進行充分電凝處理,必要時可噴灑生物蛋白膠、黏膜保護劑等保護創面。
同EMR相比,ESD不受病變大小和潰瘍的限制,實現了病變的整塊切除,提供了準確的病理評估,有利於腫瘤的治癒性切除。
3.內鏡黏膜下隧道剝離術( endoscopic submucosal tunnel dissection,ESTD) :ESTD 是消化內鏡隧道技術( Digestive endoscopic tunnel technique,DETT) 的分支之一,是通過建立黏膜下隧道,完整切除消化道早癌的新方法,主要適用於切除病變橫徑≥3 cm 的大面積早期胃癌,賁門部、胃體小彎側和胃竇大彎側是比較合適的操作部位。
ESTD 的標準操作步驟:
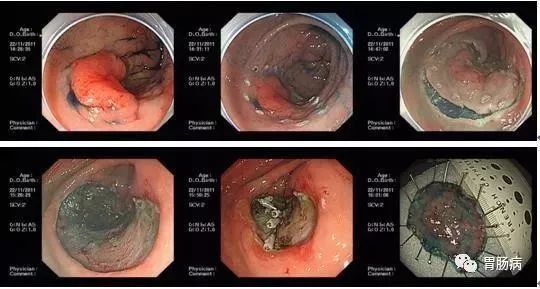
(1) 環周標記
(2) 黏膜下注射
(3) 黏膜切開:按照先肛側後口側的順序,使用電刀沿著標記切開肛側及口側黏膜,約1.5~2.0 cm。
(4) 隧道建立:從口側開口處行黏膜下剝離,邊注射、邊剝離,建立一條由口側開口至肛側開口的黏膜下隧道。建立隧道過程中注意觀察兩側標記點,並保證隧道建立方向同病變形態及走形一致,避免黏膜的過多剝離。
(5) 病變切除:電刀沿邊界同步切開兩側黏膜,直至病變完整切除。
(6) 創面處理:與標準ESD 相比,ESTD 在隧道內剝離可減少黏膜下注射次數、兩邊組織互相牽拉利於操作視野暴露,而且內鏡前端透明帽具有一定的鈍性分離作用,從而提高了剝離效率、降低併發症發生率。研究證實,ESTD 對於大面積早期胃癌,以及伴有潰瘍、嚴重纖維化的病變也是安全、有效的。
併發症及處理:
1.出血:早期胃癌內鏡下切除並發急性術中出血或遲發性出血,建議首選內鏡下止血治療。一旦出現遲發性出血,應儘快行急診內鏡止血處理。如內鏡下止血困難或失敗,需及時轉向外科行手術或介入栓塞治療。
消化內鏡手術出血ERB 分級
2. 穿孔:早期胃癌內鏡下切除並發穿孔,內鏡下多可成功處理,如內鏡下治療困難或失敗,應及時轉送外科手術。

3. 狹窄:術後並發狹窄相對少見,主要發生於賁門與幽門區,常見於術後黏膜缺損程度≥3/4 周的患者。針對胃ESD 術後狹窄的治療方法,主要有內鏡下球囊擴張和激素治療( 口服/內鏡下局部注射) 等。
4.其他併發症:除了出血、穿孔等常見併發症外,仍有一些少見併發症,如肺部感染、氣體栓塞、胃旁膿腫、胃腔血腫等,也值得警惕!
規範化的術後管理
1、一般治療:術後應根據術中情況如創面大小等,從禁食水逐漸過渡飲食,直至恢復正常飲食。期間應密切觀察生命體征及腹部體征,監測血、便常規等,必要時行腹部影像學檢查。
2、質子泵抑製劑的應用:術後預防出血和促進人工潰瘍癒合首選質子泵抑製劑( proton pumpinhibitors,PPIs)。
3、 圍手術期抗生素的應用:早期胃癌內鏡下切除圍手術期,不推薦常規預防性使用抗生素。但是當患者存在下列情況時,可考慮酌情使用抗生素: 切除範圍大、操作時間長、合併消化道穿孔或大量出血的患者及伴有糖尿病、免疫功能低下( 尤其是接受器官移植者) 、營養不良的患者等。具體用藥參照衛生部抗菌藥物使用原則。
4、Hp的根除:早期胃癌患者合併Hp感染,術後應及時行Hp 根除治療。目前推薦鉍劑四聯( PPI + 鉍劑+ 2 種抗生素) 作為主要的經驗性治療根除Hp方案。
規範化的術後監測和隨訪:
早期胃癌內鏡下切除的治癒性評估

注:pT1a(M)術後病理診斷為黏膜內癌;pT1b( SM1):術後病理診斷為黏膜下癌,且黏膜下浸潤深度< 500 μm;UL:潰瘍形成(瘢痕)。
1.治癒性切除的監測與隨訪:治癒性切除和相對治癒性切除患者,建議分別於術後第3、6、12 個月進行內鏡隨訪,此後每年複查一次胃鏡,並進行腫瘤標記物和CT 等相關影像學檢查。
2.非治癒性切除的治療策略:非治癒性切除,由於大多情況下存在較高的複發或淋巴結轉移風險,建議追加外科手術治療。
根據我國早期胃癌篩查及內鏡診治共識意見,以下病變再次行內鏡下切除或者密切觀察隨訪:
(1) 水準切緣陽性且病變長度< 6 mm 的分化型癌,但滿足其他治癒性切除的標準;
(2) 分塊切除的分化型癌,但滿足其他治癒性切除的標準。
3. 複發及處理:對於隨訪過程中出現複發的患者,由於其淋巴結轉移率與單癌灶無明顯差異,可經內鏡評估後,再次行ESD 或外科手術治療。而對於原位複發的患者,原切除創面瘢痕形成,粘連明顯,黏膜下注射效果多不理想,再次ESD 相對困難,且具有一定的出血和固有肌層損傷風險。建議由具有豐富ESD 治療經驗的內鏡專家再次嘗試ESD 切除,必要時行外科治療。
參考文獻:北京市科委重大項目《早期胃癌治療規範研究》專家組,早期胃癌內鏡下規範化切除的專家共識意見( 2018,北京).中華胃腸內鏡電子雜誌2018 ,5 (2):49-60.
作者:達明緒 來源:胃腸病
關注消化,我們有很多乾貨!







