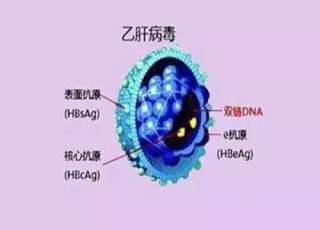
關於慢性B肝功能性治愈的另一個新藥研發方向,葛蘭素史克(GSK)的GSK3228836(GSK836 或 ISIS 505358)Phase 2a 期研究結果在上周公布。

葛蘭素史克B肝新藥,第29天評估,明顯抑製表面抗原與病毒量
說起葛蘭素史克(GSK),不得不提到20年前在我國上市的首款B肝抗病毒藥物拉米夫定,就是這家美國大型跨國藥企研發的。拉米夫定(LAM)進入中國後稱為賀普丁,該藥是我國首個B肝口服抗病毒藥,而隨著賀普丁進入中國後,慢性B肝患者(CHB)的肝炎病情也得到明顯控制。

統計數據上,我國約有9000萬左右的B肝病毒攜帶者,當中約有2000萬的B肝患者。世界衛生組織(WHO)也曾提倡2030年消滅病毒性肝炎的目標,小番健康認為,隨著成人慢性B肝創新藥研發加速,除吉利德科學外,還有許許多多有實力藥企,正在快速結合B肝不同靶點進行科學研究。

從公開資料查找到,葛蘭素史克(GSK)與Ionis製藥公司共同開發B肝創新藥,該藥物屬於第二代肝靶向反義寡核苷酸,去年11月公布該新藥正處於Phase 2a 期臨床研究,主要評估對人體的安全性、藥代動力學、耐受性。當時公布臨床試驗結論是:靶標參與伴隨 HBsAg 平均下降呈劑量依賴性。

這種結論,已經距離功能性治愈治療終點不遠,上周2020亞太肝病年會上,香港研究人員發表了對葛蘭素史克該款新藥的最新研究評估結果。GSK836的二期臨床采取隨機、雙盲已經安慰劑對照,對B肝患者(CHB)分別在第1、4、8、11、15 和 22天,選擇皮下注射GSK836,300 mg/次,第29天評估抗病毒效果。

小番健康注意到,該在研新藥二期臨床受試對象為:HBV DNA ≥ 2×103 IU/mL、HBsAg≥50 IU/mL 的 HBeAg 陽性或陰性未經治CHB。排除對象為肝硬化合並HIV、HDV、HCV感染者或者ALT或AST>5倍正常值上限(×ULN)。該藥研究結論為,未接受過任何治療的慢性B肝(CHB)在使用 GSK836四周以後,對患者的HBV-DNA和B肝表面抗原(HBsAg)具有明顯抑製作用。

該藥如B肝患者長期使用,對人體安全性以及耐受性,均表現出現適合長期治療。該藥治療組僅出現1名,在B肝表面抗原和HBV-DNA定量已經低於檢測水準,同時出現轉氨酶水準升高,升至781U/L(24×ULN)的嚴重不良反應事件;3名B肝表面抗原下降>3.0 log IU/mL,其中有2名在使用GSK836後,轉氨酶分別上升至1.7×ULN 和 15×ULN,但無症狀,此後可自行恢復到正常水準。
小番健康觀察該在研新藥,主要對人體不良反應比例為局部反應(7/18)。結語:慢性B肝功能性治愈中,B肝表面抗原是臨床醫生與B肝患者共同關注的指標參數,葛蘭素史克(GSK)研發新藥GSK3228836(GSK836 或 ISIS 505358)對CHB初始治療後B肝表面抗原(HBsAg)水準明顯降低,上周公布二期試驗對受試者包括未經治 HBeAg 陽性或陰性慢B肝患者,表現出對人體安全性和耐受性。(數據以及結論已發表在APASL2020)返回搜狐,查看更多
責任編輯: