去年九月初,Assembly Biosciences公司B肝新藥研發管道中的ABI-H2158,在II期臨床開發中,研究人員關注到丙氨酸轉氨酶 (ALT) 水準快速升高而停止了開發。小番健康先簡單介紹一下ABI-H2158的開發進程,以及全球其他同類靶點在研的候選藥物。

B肝核心蛋白變構調節劑開發,影響HBsAg有限,可調降其他標誌物
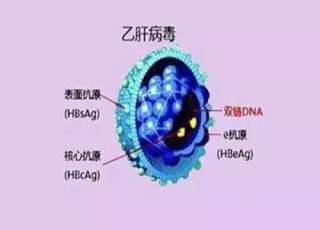
評價藥物的安全性和有效性,全球任何一個領域的新藥開發都離不開這條路徑。Assembly Bio公司的ABI-H2158是該公司第二代 CpAM抑製劑(核心蛋白變構調節劑,CpAM)。在其多中心、多劑量遞增隊列安慰劑對照 Ib期研究中,對B肝e抗原(HBeAg)陽性、未接受過治療的慢B肝受試者進行了14天的研究。
在100毫克、300毫克和500毫克每日劑量下,研究人員觀察到了HBVDNA和pgRNA的劑量依賴性下降!受試者在使用300毫克ABI-H2158劑量後,HBVDNA與pgRNA分別下降了 2.5 log 和 2.3 log,但B肝表面抗原(HBsAg)、B肝核心抗原(HBcAg)或B肝e抗原水準都沒有變化。
當進入到II期研究時,這是一項隨機、多中心、安慰劑對照在加利福尼亞進行的臨床研究,在88名初治受試者中評價了ABI-H2158的影響。除恩替卡韋外,受試者按 3:1的比例隨機分配接受 ABI-H2158或安慰劑治療72周。
結果表明,在2名受試者中發現了嚴重的ALT 4級激增,在另外2名受試者中發現了ALT 3級升高。由於科研人員無法解釋導致ALT激增的其他原因,因此,得出結論,是ABI-H2158導致的肝毒性,因而ABI-H2158已於2021年9月宣布停止臨床開發(試驗數據和結論來自:Assembly Bio)。

R07049389是一款比較早就進入人體臨床研究的核心蛋白變構調節劑。在一項隨機、多中心、安慰劑對照的 I期研究中,未接受治療的慢B肝受試者被隨機分配到不同的多個遞增劑量隊列中,連續給藥28天。
結果表明,無論劑量分配如何變化(按每日2次200毫克或400毫克,或每日1次200毫克、600毫克或1000毫克),HBVDNA平均下降超過 2.5 IU/mL,並且HBVRNA水準下降也遵循了以上規律。在停藥後,HBVDNA和RNA水準恢復到基線水準。然而,在使用R07049389或安慰劑 28天后,沒有觀察到B肝e抗原或B肝表面抗原水準的明顯變化。
安全性方面,最常見不良事件是頭痛和ALT和AST升高,並在隨訪期間恢復到基線水準。R07049389已經進入到 II期較長時間的臨床開發中(試驗數據和結論來自:羅氏製藥)。

小番健康結語:也許當您看到這一藥物靶點候選藥物時,大部分規律是此類候選藥物都沒能夠對B肝表面抗原產生任何影響。實際上,核心蛋白變構調節劑的開發一開始也不是朝著設計調降表面抗原水準,它的機制主要是針對衣殼組裝步驟,這有別於核苷類藥物的機制。它們多數已在臨床開發中,證明能夠顯著降低HBVDNA和RNA、pgRNA水準,這一類候選藥物還有一些潛力是間接抑製cccDNA。返回搜狐,查看更多
責任編輯: