糖尿病和癌症之間,是否存在著某種未被科研發現的聯繫?為何防治糖尿病的藥物二甲雙胍能夠在預防癌症的舞台上大顯身手?北京時間7月19日凌晨,《自然》雜誌在線發表了復旦大學生物醫學研究院施揚/石雨江教授團隊的重大科研成果。以《葡萄糖通過AMPK介導的對TET2蛋白的磷酸化調控揭示了糖尿病與癌症內在關聯的新通路》(「Glucose-regulated phosphorylation of TET2 by AMPK reveals a pathway linking diabetes to cancer」)為題的論文,對上述問題做了解答。該課題由復旦大學、復旦大學附屬中山醫院及哈佛布雷根醫院合作完成。復旦大學分時特聘教授、哈佛大學副教授石雨江為論文通訊作者。糖尿病患者為何更易患癌症?臨床研究發現,糖尿病患者患癌症的比率已明顯高於非糖尿病患者,而治療糖尿病的藥物二甲雙胍也在降低癌症風險上展現出優良成效。糖尿病和癌症之間,是否存在著某種聯繫?事實上,導致癌症的原因有許多。除了為眾人所熟知的DNA序列突變與基因遺傳,還有許多來自於基因密碼之外的因素。如水、空氣、營養等環境因素都可能在特定情況下,對人體遺傳性狀進行調控,使得一部分健康的基因組產生非正常表達,甚至是「失語」。當身體內原本堅固的抗癌防線逐步失去效用,患癌症的風險自然也就增高了。以上正是表觀遺傳學的研究基礎。以此為視角重新審視致癌背後的原因,為石雨江團隊最終發現糖尿病與癌症之間的新通路,提供了理論依據。那麼,營養環境是如何影響癌症的產生呢?TET2蛋白催化DNA上5mC向5hmC修飾的轉化。在癌細胞裡5hmC水準出現廣泛的下降,可作為衡量癌症惡性程度的標誌(cancer hallmark)。石雨江團隊在實驗中發現,高血糖水準會顯著抑製身體內AMPK蛋白激酶的活性,導致TET2Ser99磷酸化與TET2蛋白穩定性降低,以減少TET2蛋白催化生成5hmC。當5hmC減少,意味著腫瘤發生的可能性也隨之增大。簡言之,這一新通路就好比一根鏈條,糖尿病患者體內的高血糖水準正是鏈條的一個埠。在環環相扣的連鎖反應之下,高糖環境最終會破壞5hmC表觀抑癌修飾的生成。表觀抑癌修飾變少了,患病風險自然大大提高。石雨江團隊的創新成果為糖尿病與癌症之間的關係找到了一條不同於以往代謝視角的新通路。研究不僅揭示了糖尿病與癌症之間確實存在著傳導通路,還指出部分糖尿病治療藥物也能有效地降低部分癌症爆發的風險。該項研究對於理解糖尿病與腫瘤發生的關係具有重要意義,為腫瘤防治研究提供了全新的思路與可能。
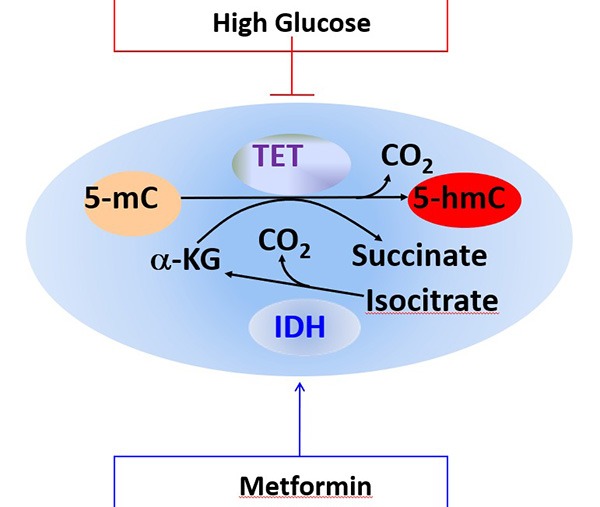

糖尿病高血糖和癌症內在關聯的表觀遺傳通路,以及二甲雙胍在抑製腫瘤中的表觀遺傳作用機理。復旦大學供圖為預防癌症的藥物研發提供新可能既然糖尿病與癌症之間確實存在著傳導通路,那麼治療糖尿病的相關藥物是否也同樣對預防癌症有一定幫助呢?為了驗證猜想,石雨江團隊以糖尿病治療藥物二甲雙胍為例進行了實驗。研究發現,二甲雙胍通過激活AMPK,磷酸化下遊的TET2,增強TET2穩定性和其產物5hmC,來對腫瘤生長達到抑製。並且二甲雙胍的抑製作用要明顯依賴於TET2的存在。雖然二甲雙胍多年廣泛應用於臨床,其它的作用機制卻一直不明確,該發現是首次報導AMPK與TET2相互作用,將能量調控和表觀遺傳關鍵酶直接聯繫在一起,並且揭示能量調控要依賴於表觀遺傳調控。以此為例,藥物是否能有效預防部分癌症的關鍵不在於血糖濃度的高低,而在於能否真正激活AMPK蛋白激酶以穩定TET2蛋白增加5hmC水準,以保證人體細胞的後續工作正常運行。通過服用糖尿病相關藥物以降低血糖濃度,確實能在一定程度上同時降低高血糖水準對AMPK蛋白激酶的抑製程度,但這並不意味著蛋白激酶就能由此重新煥發「活力」。但是少攝入糖分,保持體內血糖始終維持在較低水準,減少對AMPK蛋白激酶的抑製頻率,提高TET2蛋白的穩定性,升高5hmC水準,對防治部分腫瘤依然有著積極作用。此項研究也將為更多臨床研究和預防癌症的藥物開發奠定基礎。研究緣起一次偶然的嘗試談及研究緣起,石雨江表示其實這整個項目都誕生於一次意外且偶然的嘗試。2010年春天,復旦大學2008級博士生胡笛來到石雨江位於哈佛大學的實驗室,參與兩校聯培。2011年夏天她接手了OGT(葡萄糖胺轉移酶)和TET2相互調控的課題。起初的猜想是OGT通過糖基化並切割TET2來影響TET2穩定性。遺憾的是,在接下來的半年時間裡,胡笛的實驗始終進展不順。經過一段時間的嘗試後,她不得不從源頭來尋找可能性。或許使用葡萄糖作為調控因子,直接檢驗葡萄糖濃度是否會對TET2產物5hmC產生影響,能為實驗帶來轉機呢?在石雨江和同伴吳鏑的建議下,胡笛重新更改了實驗方法。令人驚訝的是,在低糖條件下培養的細胞5hmC竟然出現了顯著升高。葡萄糖和TET2蛋白之間確實存在著緊密的聯繫。正當實驗開始朝著嶄新的方向發展時,有關OGT和TET2蛋白調控機制的文章陸續刊登在了各大期刊中。同行學者們的實驗結果,一次次導向並驗證了OGT對TET2蛋白的穩定性並不造成調控與影響。這恰恰與課題組的猜想背道而馳,實驗再次陷入了被「雙殺」的境地。既然葡萄糖不是通過OGT來對TET2進行調控從而影響5hmC,那麼實驗結果又是因何而來呢?帶著疑惑,吳鏑再次回顧了過往的實驗數據,一個看似不相關的結果首次跳入了他的腦海,「或許,葡萄糖是通過磷酸化TET2來實現調控的。」正是這一猜想,將研究成功引向了最終的航道。本是計算生物學背景出身的吳鏑當時正在哈佛的另一個實驗室工作。作為項目的共同開拓者,在初始的一段時期裡,吳鏑利用每天晚上下班後,和次日早晨上班前的這段休息時間,泡在實驗室裡進行實驗。半夜離開,凌晨歸來,吳鏑的付出最終為後續解決關鍵性問題打下基礎。不久後吳鏑正式加入了石雨江團隊。2012年春天,胡笛在哈佛的聯合培養業已結束。帶著剛剛步入正軌卻前途未卜的課題,胡笛回到了復旦實驗室。每日只能通過電話,和仍在美國的吳鏑溝通實驗進展。與此同時,經過反覆查找,石雨江終於在一個叫作「AMPK」的激酶上找到了希望。石雨江的另一位博士生陳浩也為實驗添上了重要的一環。所有的元素終於被串聯起來: 低糖可以激活AMPK,後者可以磷酸化TET2,從而影響到最下遊的5hmC。胡笛馬上著手動物學實驗,結果出人意料得好。再次回首整個研究,石雨江表示, 「我們做科研就像是許多學者共同繪製一幅畫作,一步步點亮科學未知的地圖。有人為畫作添上鼻子,有人畫一雙眼睛。我們每個人所做的其實都只是這幅畫作中極其微小的一部分。但是當這些微小的拚圖一塊塊連接在一起時,科學的圖紙就會變得越來越寬闊。」