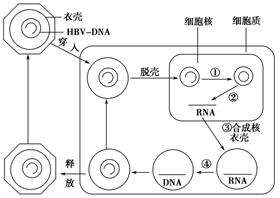
南非威特沃特斯蘭德大學和德國弗萊堡大學醫學中心的研究人員在科學雜誌《Viruses》上,發表了一項和HBV治愈有關的最新進展,這項研究進展旨在說明結合切割病毒DNA的轉錄激活因子樣效應核酸酶(TALEN)提供一種新方法。

B肝工程核酸酶研發前景,技術改良後,可以提高小鼠特異性
研究人員認為,持續的B肝病毒感染依然是全球性醫療問題,估計全球有2.57億B肝病毒攜帶者。可以使用預防性疫苗、免疫調節劑、核苷酸和核苷類似物等形式進行預防和治療乾預。然而,接種預防性疫苗對於慢性B肝患者沒有益處,並且對感染率的影響有限。儘管免疫調節劑和核苷類似物,已獲準用於治療慢性HBV患者,但治愈率仍然很低。
TALEN技術,它可以直接靶向共價閉合環狀DNA(cccDNA),並有可能永久地禁用這一重要的病毒複製中間體。從研發難點看,工程核酸酶潛在的脫靶裂解導致毒性是該技術的局限性!為了解決這一問題,在HBV基因治療背景下,現有的靶向病毒核心和表面開發閱讀框的TALEN被第二代和第三代Fokl 核酸酶結構域修飾。
作為專性異源二聚體,這些TALEN可以防止Fokl同源二聚化導致的靶標裂解。第二代專性異二聚體TALEN,在沉默B肝病毒基因表達方面與第一代對應物一樣有效,並且在B肝病毒複製的小鼠模型中,表現出更高的特異性!ZFN和TALEN,被設計為左右單體,它們在預期的DNA靶序列上聚集在一起,允許它們的Fokl核酸酶結構域二聚化並產生雙鏈斷裂。

然而,研究人員發現左/左或右/右同源二聚體也可以組裝,從而在這些非預期位點進行功能性Fokl二聚化和切割。為了限制這種可能性,第二代和第三代Fokl核酸酶結構域,被確定為僅在發生左/右異二聚化時才起作用。例如,Q486E與 I499A和E490K以及 I538V一起產生的 ZFN 單體作為同二聚體的作用很差,但作為異二聚體卻非常有效。
隨後一項研究確定了FokI 核酸酶結構域的其他修飾,例如 ELD(Q486E、I499L、N496D)和 KKR(E490K、I538K、H537R)突變,從而產生了改進的專性異二聚體 ZFN 。研究人員還確定了增強Fokl核酸酶結構域催化活性和提高ZFN功效的修飾。這些所謂的Sharkey 突變(S418P 和 K441E)也可以減少核酸酶的脫靶突變,因為需要較低的劑量才能產生治療效果。
在這裡,我們評估了第二代TALEN(Q486E、I499A、E490K 和 I538V 專性異二聚體)以及具有 Sharkey 突變的第三代 TALEN(ELD 和 KKR 專性異二聚體)用於抗 HBV 的用途。總體來說,第二代專性異源二聚體的療效與最初的第一代抗HBV TALENs的療效相當。儘管觀察到靶向核心ORF的第二代專性異二聚體 TALEN 對病毒複製的抑製水準相似,但在體內觀察到較低的靶標破壞!
相比之下,含有Sharkey 突變的第三代 TALEN 對 HBV 的沉默活性降低,這一結果與此前已有報導結果類似,這表明將Sharkey 突變納入TALEN結構,更具體地說,納入第三代Fokl核酸酶結構域,對沉默活性有害。Sharkey突變是由 ZFN 的定向進化產生的,可能是TALEN內沉默活性降低的原因。

小番健康結語:南非和德國研究人員發表的這項研究,是在說明這種工程核酸酶技術(如TALEN),具有直接靶向和滅活cccDNA的能力,這種能力使得TALEN成為一種值得探索的慢性HBV感染治療方法。TALEN和Cas9功能,已被證明受異染色質限制。最近數據表明,TALENs在導航緊密DNA方面的表現優於Cas9核酸酶。
這些研究發現在HBV治療領域很重要,因為cccDNA已被證明以異染色質狀態存在。雖然TALEN被異染色質阻礙,但其活性並未完全受到抑製,並且核酸酶能夠在異染色質內導航,比Cas9核酸酶更是如此,Cas9核酸酶在詢問目標位點之前必須分離雙鏈DNA。病毒DNA的有效靶向依賴於TALEN與靶序列的結合,這可能會被逃逸突變破壞。
HBV測序數據的分析確定了描述TALEN靶位點的有限變異性。此外,需要同時靶向HBV基因組內的多個位點來限制病毒逃逸。脫靶效應的表征和TALEN表達序列的有效傳遞載體開發,對於該技術最終臨床轉化仍然至關重要。TALEN技術可以很好地填補抗HBV療法的重大空白。

解讀TALEN技術研發特點和前景
目前醫學知識進展至今,發現慢性HBV感染持續性源自於病毒cccDNA,它在感染過程中被確立為穩定的附加型微染色體。實現功能性治愈HBV,包括完全抑製cccDNA活性,這一目標越來越被認為是能夠實現的目標,而不是必須完全清除所有病毒庫的滅菌治愈。工程核酸酶技術,有可能直接靶向cccDNA,並誘導破壞性突變來永久滅活這種病毒中間體。
研究已於2021年7月12日由南非威特沃特斯蘭德大學、德國弗萊堡大學醫學中心研究人員發表在科學雜誌《Viruses》上。返回搜狐,查看更多
責任編輯: