在現有科學家已掌握的B肝新藥開發技術中,單鏈寡核苷酸在臨床前研究中,表現出對B肝表面抗原表達相當的效力。另一種則是我們熟悉的干擾素刺激基因 (ISG),因為它不僅具有降解cccDNA功能作用,而且還可以直接和HBV pgRNA的ε 區域結合。接下來,我們就來了解一下,這兩種已被科學家發現的B肝藥物開發的新技術。

B肝新藥開發領域,三種技術,已經被科學家探索並驗證中
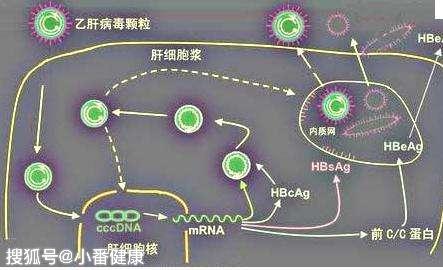
單鏈寡核苷酸,又名單鏈DNA樣寡核苷酸(SSO),它們可以結合mRNA靶標,通過核糖核酸酶H(RNase H)活性介導其降解。這些寡核苷酸一般使用鎖核酸(LNA)技術進行修飾。鎖核酸是核苷(酸)類似物,它已經被科學家探明其穩定的整個結構,並還可以提供細胞內穩定性。
鎖核酸早期研究中,使用Alexa546熒光素標記LNA修飾的寡核苷酸,LNA-Alexa寡核苷酸在HepG2.2.15細胞中,轉染後24小時,顯示出獨特的核定位與對HBV pgRNA的有效抑製作用。除了上述早期對LNA研究發現外,科學家還選擇了一種反義寡核苷酸,來靶向X開放閱讀框中所有B肝病毒基因型中最保守的區域。
未修飾的寡核苷酸並不穩定,而經過修飾後的那些則表現出安全、穩定和有效特性。最近,已有科學家使用工程化LNA-SSO進一步將其與三個GalNAc部分綴合,來促進與肝髒ASGPR的特異性結合。可以引起業內關注的是,這種GalNAc-LNA-SSO,在AAV- HBV轉導的小鼠模型中,已經顯示出非常高的效力,並可以導致B肝表面抗原持續下降。

干擾素刺激基因 (ISG),是另一種科學家已經探索到的現有B肝藥物開發技術。ISG除了被發現具有降解cccDNA作用外,例如,核糖核酸ISG20還被發現可以直接與HBV pgRNA的ε 區域結合,並在存在輔助因子的情況下將其降解。科學家進一步的研究表明,N6甲基腺苷修飾的病毒轉錄物被ISG20選擇性感知,並進行降解處理。

越來越多科學研究表明,基於寡核苷酸技術開發的抑製劑作為HBV治療劑,已經開始走向成熟,如shRNA和siRNA。基於這個方向的醫藥技術,其中多數是通過RNA誘導的沉默複合物(RISC)介導其抗病毒作用的小RNA,或者是募集RNase H介導的mRNA降解單鏈DNA樣分子。
以往在驗證這些新技術的研究中,小鼠被共轉染或流體動力學注射,其中一個HBV表達質粒和另一個編碼與HBV mRNA同源的小髮夾RNA(shRNA)的質粒。此後,使用合成的小干擾RNA(siRNA)轉染攜帶穩定HBV整合體的HepG2.2.15、HepAD38和HepAD79細胞系。經RNAi處理後,科學家發現,轉染細胞中分泌的B肝表面抗原大幅減少,小鼠血清中分泌的B肝表面抗原也相應大幅減少,而肝內B肝核心抗原水準也呈現大幅減少。
科學家還曾經使用編碼這些靶向shRNA的重組腺病毒轉導的HBV轉基因小鼠,對另一種候選shHBV765進行了評估。在第26天時,經過該處理後減少了小鼠的preS/S 轉錄本,並在較小程度上減少了pgRNA。這些早期研究都說明,活性轉錄不僅來自附加型質粒,也來自病毒基因組整合體,可以成功地靶向shRNA和siRNA。

小番健康結語:藥品研發需要相應的醫藥技術,以RNAi為例,目前已有聯合衣殼組裝調節劑(CpAMs)、核酸聚合物(NAPs)以及核苷(酸)類似物(NAs)的臨床試驗例子。比如,GaINac綴合的siRNA就被科學家發現,它與在研治療性B肝疫苗、HBV特異性CD8+T細胞的發育方向,表現出更為強效的免疫刺激作用。
當然,儘管RNAi+NA組合方法正在臨床試驗概念驗證中,但已使用NA的病毒抑製CHB,是否可以被其他病毒導向劑替代還有待科學界進一步觀察。返回搜狐,查看更多
責任編輯: