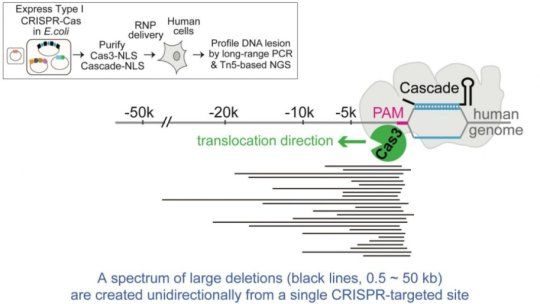
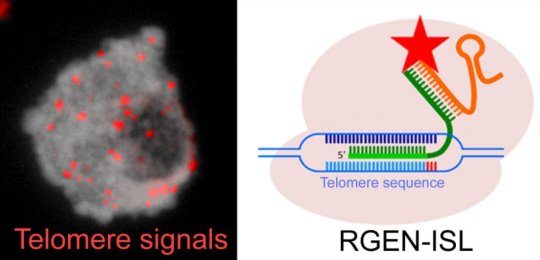
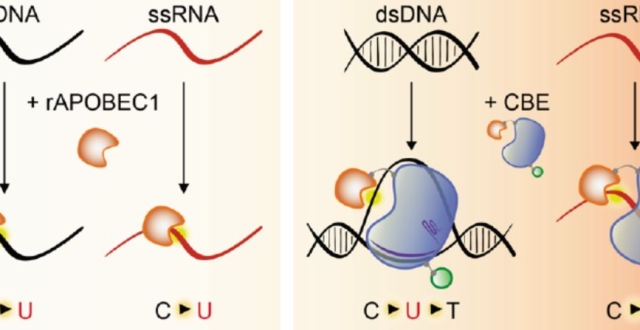
2022年諾貝爾各獎項,今天開始將陸續揭曉。小番健康比較關心的是,今年的生理學或醫學獎和化學獎這兩個。還記得,2020年一種基因編輯方法也稱“基因剪刀”的 CRISPR/Cas9,兩位科學家因研發出它而獲得了當年諾貝爾化學獎(分別是法國科學家埃瑪紐埃爾·沙爾龐捷、美國科學家珍妮弗·杜德納)。

B肝藥研潛在工具,2022諾獎前,淺談2020年CRISPR/Cas9工具前景
這種工具在使用便捷性與成本方面,都比較有優勢,同時,最近幾年使用 CRISPR/Cas9 來治療B肝病毒(HBV)也表現出比較高的創新藥開發前景。目前,全球科學家們都在開發B肝創新藥物,原因之一是現有抗病毒藥物,如核苷(酸)類似物(NAs)和干擾素(IFN)還遠無法滿足HBV領域需求,科學家們正在探索新機制和新穎化學結構化合物。
當前療法,還很難實現讓B肝表面抗原(HBsAg)消失,它是目前科學家們提出功能性治愈HBV的主要最終目標。基因編輯技術應用在HBV,有優勢和前景,目前也有受限制因素。在 CRISPR/Cas9 系統問世前,已有兩種基因技術,如鋅指核酸酶 (ZFNs)和轉錄激活因子樣核酸內切酶 (TALENs) ,CRISPR/Cas9是更晚研發出現的一種可用來基因組編輯的工具。
這種工具會導致特定序列DNA斷裂,科學家們曾經在許多早期試驗中使用過 CRISPR/Cas9,並顯示CRISPR/Cas9可以從宿主基因組中去除整合的HBVDNA,並有效降解HBV cccDNA。所以,從最終解決問題方向,基因編輯可能是消除cccDNA的潛在方法之一。

三種基因編輯工具,有近似之處,比如它們均通過運用設計的核酸酶靶向與改變DNA序列,從而導致靶向雙鏈DNA的斷裂,促進細胞DNA修複系統。不同之處是,它們設計的核酸酶、識別域是不同的。此外,ZFNs與TALENs技術運用的是 Fok I 酶以破壞目標DNA,但 CRISPR/Cas 使用到的則是 Cas 蛋白。
簡而言之,新出現的CRISPR/Cas9基因編輯技術是有潛力和創新藥開發前景的,但目前這類研究進展多在早期的細胞培養模型中看到試驗數據,這種技術也存在一些缺點有待改進,比如,體內遞送效率和脫靶意外切口等。

畢竟,一項新技術的誕生到成熟,還需要經歷許多時間,如果可以克服上述問題,CRISPR/Cas9技術在治療慢性B肝方面,就會具有相當高的前景。同時,CRISPR/Cas9也在治療其他疾病領域具有很高前景,在此就不作詳細介紹。總之,當科學家們在考量消除HBV感染所面臨的主要障礙時,cccDNA在當前抗病毒療法下依然能保持其穩定性,這就促使科學家們考量一些可以直接靶向cccDNA的工具,使用基因編輯來沉默cccDNA的表達,不得不說,已是一種潛在方法。
目前,研發以口服劑型的NA,這類抗病毒療法儘管能夠顯著阻止HBV複製,但NA還無法根除在肝細胞核中積累的HBV cccDNA,它是HBV複製的原始模板。返回搜狐,查看更多
責任編輯: