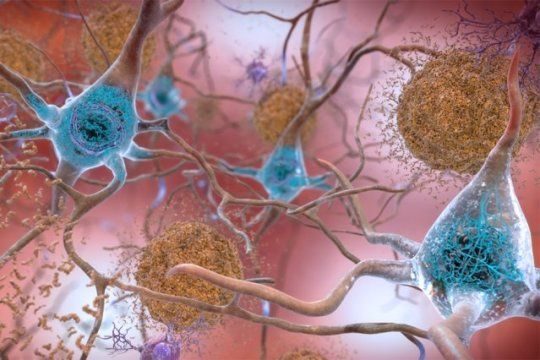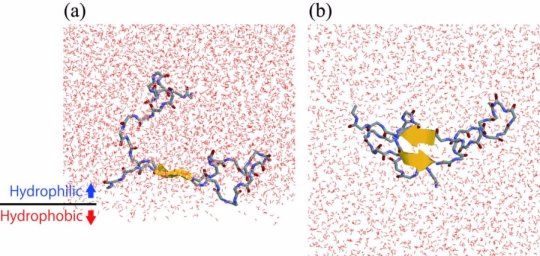

(a)在親水/疏水界面處形成β-髮夾結構的A-β肽。(b)從小組(a)的底部查看。
許多蛋白質在較高濃度下聚集並形成稱為低聚物和稱為澱粉樣蛋白原纖維的針狀物質的球形物質。這些蛋白質聚集體引起超過30種疾病,例如,阿爾茨海默氏病被認為是由澱粉樣蛋白-β(Aβ)肽聚集形成的寡聚體和澱粉樣蛋白原纖維引起的。已知Aβ肽的聚集在親水/疏水界面如細胞膜表面加速。然而,為什麼Aβ肽傾向於在表面聚集尚不清楚。
日本生命和生命系統探索研究中心和日本分子科學研究所的研究小組利用分子動力學模擬和核磁共振光譜實驗研究了這個問題。他們發現Aβ肽傾向於聚集在親水/疏水界面。也就是說,界面處的Aβ局部濃度高於本體水溶液中的局部濃度。另外,β-髮夾結構在界面處比在本體水溶液中更多地形成。在β-髮夾結構中,如圖所示,Aβ肽的一部分直接延伸並形成分子內氫鍵。因此,接近該肽的另一種Aβ肽易於產生分子間氫鍵並趨於聚集。通過這種方式,
這一發現使我們能夠闡明Aβ肽在神經細胞膜表面聚集的機制。闡明這種機制將用於開發未來抗阿爾茨海默病致病物質的抑製劑。