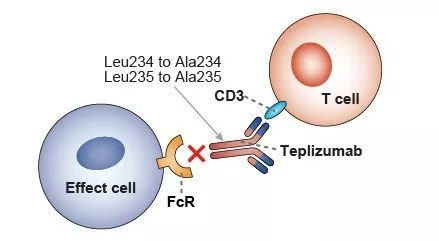
近日,美國生物製藥公司Provention Bio宣布,美國食品藥品管理局(FDA)授予teplizumab(PRV-031)突破性藥物資格(BTD),用於預防或延緩1型糖尿病(T1D)。
資料顯示,1型糖尿病是一種免疫系統疾病,起病急劇。多發生在兒童和青少年,也可發生於各種年齡。患者自身免疫系統會錯誤攻擊人體內生產胰島素的β細胞,導致沒有足夠的胰島素去控制血糖水準。
目前該病尚無有效治癒手段,患者需要終身使用胰島素治療。


FDA授予teplizumab BTD資格的決定是基於「At-Risk」研究的臨床數據。這項研究由美國國立糖尿病、消化和腎病研究所(NIDDK)贊助,並得到青少年糖尿病基金會(JDRF)的額外支持,旨在評估teplizumab用於高危群體預防或延緩發生T1D的療效性和安全性。該研究相關成果已發表在美國《新英格蘭醫學雜誌》上。
研究納入了76名年齡在8到49歲之間的患者,這些患者存在2種或多種T1D自身抗體和異常的葡萄糖代謝(血糖異常),其中72%的參與者年齡在18歲以下。受試者隨機接受teplizumab或安慰劑治療。
研究結果顯示,與安慰劑相比,接受單次14天療程的teplizumab治療後,可延遲T1D發病時間至少2年。
安慰劑組患者臨床診斷T1D的中位時間僅為24個月。相比之下,teplizumab治療組患者臨床診斷T1D的中位時間僅為48個月。在試驗期間,安慰劑組中72%發生臨床糖尿病,而teplizumab組僅有43%。teplizumab耐受性良好,安全性數據與新診斷患者的既往研究一致。
「我們很高興FDA看到teplizumab在T1D治療中的潛力,我們致力於與該機構合作,儘快將這一候選藥物帶給患者。「At-Risk」的突破性數據首次顯示,teplizumab可能延遲T1D的發病,我們期待與FDA討論後續步驟,並在未來幾個月內提供有關該過程的最新信息。」Provention Bio首席執行官阿什莉·帕爾默表示。


teplizumab是一種實驗性抗CD3單克隆抗體,被開發用於攔截和預防1型糖尿病。該抗體已在多項臨床研究中進行了評估,涉及超過1000例患者,其中超過800例患者接受了teplizumab治療。此前在新診患者中開展的研究顯示,teplizumab持續證明了其保持β細胞功能和減少外源性胰島素使用的能力。
1型糖尿病目前已困擾全球3000萬患者。在我國,2010—2013年,中國13 個研究區域收集了超過20000 例病例, 發現T1D 全年齡段發病率為0.93/10萬。預估全國每年新增超過13 000例T1D患者,其中超過9000例為15歲以上的成年人。
這一研究結果對於T1D高危風險患者將有重要意義,可使得他們能夠從早期篩查和治療中獲益。
參考資料:
1.http://investors.proventionbio.com/2019-08-05-Provention-Bio-Announces-Breakthrough-Therapy-Designation-for-Teplizumab-PRV-031-for-the-Prevention-or-Delay-of-Clinical-Type-1-Diabetes-in-At-Risk-Individuals
2.http://investors.proventionbio.com/2019-06-09-A-Single-Course-of-Proventions-PRV-031-Teplizumab-Delays-Type-1-Diabetes-Onset-in-High-Risk-Individuals-by-at-Least-Two-Years