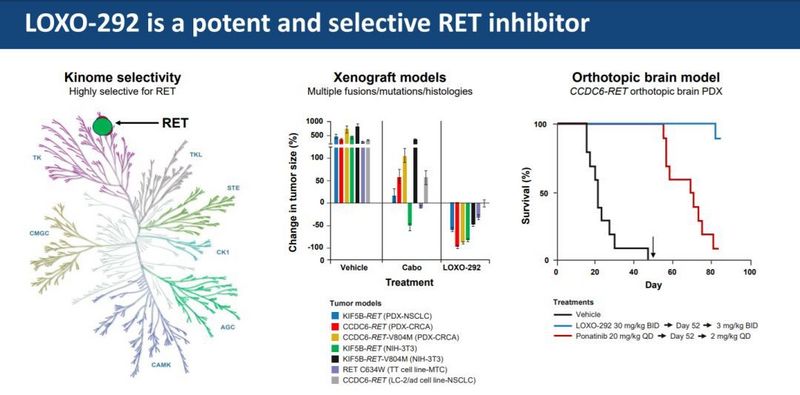
近日,新型選擇性RET抑製劑LOXO-292獲得美國食品和藥物管理局(FDA)突破性療法認定,用於治療全身治療、先前治療後進展且沒有其他可接受替代治療方案的晚期RET融合陽性甲狀腺癌。如果臨床證據表明一種藥物可能在一個或多個臨床重要終點上對現有療法有實質性改善,FDA會據此授予其突破性療法認定,旨在加快開發和審查嚴重或危及生命疾病的治療藥物。早在2018年9月,LOXO-292就兩次被認定為突破性療法,分別用於治療RET融合基因陽性的非小細胞肺癌(NSCLC)患者和RET基因突變甲狀腺髓樣癌(MTC)患者。
這次認定基於正在進行的1/2期LIBRETTO-001試驗(NCT03157128)的數據,該試驗也是其他兩次突破性療法認定的基礎。前兩次認定中,一次是針對需要全身治療、經過鉑類化療和抗PD-1,或抗PD-L1治療後有進展的轉移性RET融合陽性NSCLC患者,另一次是針對需要全身治療、在先前治療後病情進展且沒有其他治療方法可選的RET突變MTC患者。


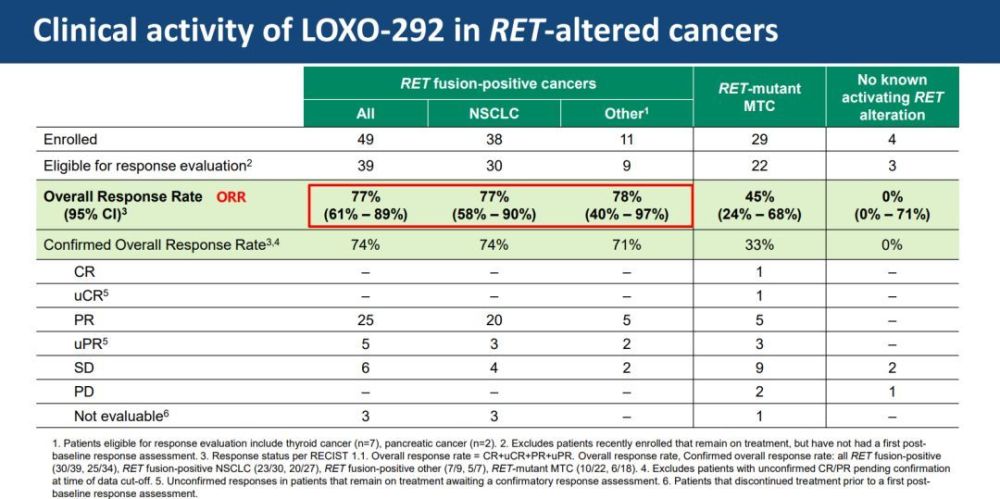
美國甲狀腺協會第88屆年會發表了LIBRETTO-001研究的新數據,其中包括RET突變MTC和RET融合陽性甲狀腺癌患者(38例患者)的試驗數據。據醫伴旅了解,94%(16例患者)RET突變MTC患者和100%(7例患者)的RET融合陽性甲狀腺癌患者仍在接受治療,中位隨訪時間分別為8.4個月和8.5個月,總體反應率分別為59%和78%。
在II期臨床試驗中,LOXO-292的應用劑量為每日2次,每次160mg,劑量探索為200mg,以進一步了解LOXO-292的安全性和功效。在安全性分析的82例患者中,大多數治療後出現的不良事件(TEAE)的嚴重程度為1級,並確定與LOXO-292無關。


2012年11月19日,卡博替尼(cabozantinib、Cabozanib、Cabometyx)由美國FDA批準上市,用於不可手術切除的惡性局部晚期或轉移性甲狀腺髓樣癌(MTC)的治療。卡博替尼是一種口服給葯的小分子廣譜激酶抑製劑,能夠有效地抑製多個受體靶點。這些受體均參與到了腫瘤的血管生成、侵入、轉移和耐葯等一系列進程,可阻斷腫瘤細胞發生和發展。


試驗表明,卡博替尼明顯地延長了甲狀腺髓樣癌患者的無進展生存期。一項入組了330名晚期甲狀腺髓樣癌的三期臨床試驗,2:1分組,一組接受卡博替尼治療,一組接受安慰劑治療,最低隨訪了42個月,結果顯示:卡博替尼明顯延長了總生存期(26.6個月vs21.1個月),延長了5.5個月。其中,卡博替尼組中位無進展生存期達到11.2個月,安慰劑組為4個月;其中,有RET基因突變的患者獲益更多。
本內容為醫伴旅版權所有,轉載請註明出處。
醫伴旅:尋找優質醫療資源,伴您走上康復之旅