SBRT聯合胸腺肽α1治療經重度治療的轉移性食管鱗癌
目前食管癌仍全球高發,在我國食管鱗狀細胞癌約佔全部食管癌的90%。食管癌的治療方式包括手術、化療及放療等,但遺憾的是即使多種治療方法聯用,多數患者最終仍會出現腫瘤複發或轉移。近年來,放療及免疫治療的協同作用得到了學術界的廣泛關注。最近,一項發表在《腫瘤免疫學雜誌》上針對轉移性食管鱗狀細胞癌(mESCC)的前瞻性臨床研究表明,立體定向放射療法(SBRT)與胸腺肽α1(Ta1)聯用可為患者帶來生存獲益。本期IO治療時訊邀請中國醫學科學院腫瘤醫院惠周光教授和翟醫蕊醫生對該項研究進行點評。
論文摘要
研究背景
本研究探索了立體定向放射療法(SBRT)聯合Ta1在經重度治療的mESCC患者中的抗腫瘤作用。
研究方法
本研究共入組31例患者,每位患者至少存在2處可測量轉移灶。針對每處轉移灶,SBRT每日劑量為5.0 Gy,1周內總劑量為25 Gy。同時,Ta1(1.6mg)每周皮下給葯2次,之間間隔3-4天,直至照射野外其它(遠處)轉移灶進展。主要研究終點為抗腫瘤作用,即通過CT/MRI評估其它可測量病灶。次要研究終點包括安全性、生存結局以及免疫相關的血液學參數。ClinicalTrials.gov註冊號:NCT 02545751。
研究結果
3例(9.7%)患者出現部分緩解(PR),11例(35.5%)患者的轉移灶穩定(SD),轉移病灶控制率(DCR)為45.2%。17例(54.8%)患者遠處轉移灶出現腫瘤進展(PD)。中位總生存期(OS)為5.2個月(95% CI:4,3-6.1個月),中位遠處無進展生存期(APFS)為2.9個月(95% CI:2.2-3.6個月)。遠處控制組(遠處轉移灶隨訪12周時無進展)的中位OS和APFS分別為5.6個月(95% CI:2.4-8.7個月)和3.0個月(95% CI:1.3-4.7個月),而非控制組的中位OS和APFS分別為5.0個月(95%CI:3.6-6.3個月)和2.2個月(95%CI:1.4-3.0個月)。亞組分析顯示,遠處控制組與非控制組的生存結局存在顯著差異(P值分別為0.035和0.044)。治療相關毒性可接受,未發生4級急性毒性事件。淋巴細胞免疫監測表明,遠處控制組與非控制組在治療後,CD8+ T細胞的比例存在顯著差異(23.18±6.41 vs 18.76±5.43,P=0.047)。
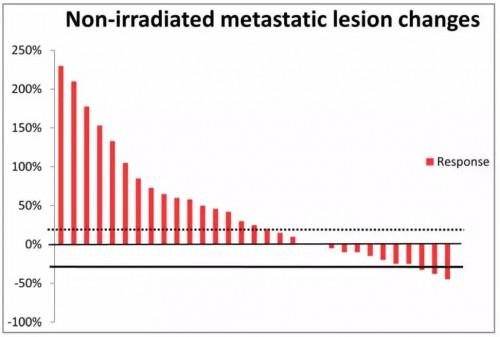

未經照射轉移灶的變化瀑布圖


全部患者的OS及APFS曲線和遠處對照組與非對照組的OS曲線


急性治療相關不良事件
研究結論
綜上所述,SBRT與Ta1聯合治療在經重度治療的mESCC患者中產生了令人鼓舞的療效。對放療增強免疫治療的研究仍需進一步探索。


惠周光
中國醫學科學院腫瘤醫院特需醫療部主任、乾部保健處副處長,主任醫師,博士生導師,協和特聘教授。中央保健會診專家、首都十大傑出青年醫生。中華醫學會放療青委會副主委、中國抗癌協會腫瘤放療青委會副主委、中國衛生資訊學會健康醫療大數據腫瘤專業委員會副秘書長。主持多項國家重點研發計劃項目。


翟醫蕊
中國醫學科學院腫瘤醫院主治醫師,博士。北京醫學會放射腫瘤學分會泛京津冀術中放療協作組秘書長,委員。8篇第一作者摘要入選美國放療年會。主持院級課題2項;多次擔任歐洲放療學會補習班及國際胸科大會英文口譯員;參編或編譯多部學術論著。目前主要研究方向為胸部腫瘤的放療及術中放療。
專家點評:
近年來,腫瘤免疫治療相關研究方興未艾。當人們紛紛把目光投向標新立異的免疫藥物、免疫靶點之時,吳式琇教授獨闢蹊徑,著眼於Ta1這一經典藥物和放療的緊密協作。這也是本研究的返璞歸真之處。
一、老壇新酒,暗香盈袖
作為一種經典的提高免疫力的藥物,Ta1早已經被廣泛應用於臨床。而同樣的,SBRT作為一種常用的技術,也在早期腫瘤和轉移性腫瘤中得到了大力的推廣。可以說這兩種治療模式都是臨床實踐中非常常用的成熟的治療模式。而這兩種模式各有特色,SBRT代表了局部精確治療,而Ta1則是提高全身免疫力的一種治療手段。本研究將兩種治療模式應用於我國的高危、高發的病種——食管鱗癌,兼顧了全局和重點,並取得鼓舞人心的療效。
二、量體裁衣,蜉蝣之羽
從入組標準看,本研究入組的是具有兩個以上的複發轉移灶的食管癌病例,且對於轉移灶的診斷定義給出了清晰的界定。而在最後入組的病例中,治療病灶以肺部和肝臟轉移灶居多。這兩個部位的轉移灶也確切符合SBRT的適用標準。
在治療實施階段,我們知道,不同的分割劑量和總劑量可能帶來的療效和毒副作用的不同。即使在一些較大的SBRT前瞻性研究中,也存在分割劑量的異質性。而本研究中,整體採用了5Gy×5次這種較中和而通用的劑量,統一的劑量避免了劑量分割方面的偏倚。
而在安全性方面,眾所周知,多項研究業已表明在放療期間使用提高免疫力的藥物可以提高放療耐受性,減少放療的毒副作用,故而本研究中放療聯合Ta1的毒副作用也在正如我們所料之中,3度以上的毒副作用較罕見。列表中的相對較多的3度以上的毒副作用是血液學毒性和肝功異常,而這兩者的發生考慮與下列因素相關:1、所有患者既往均接受過重度治療,對進一步治療的耐受性較差;2、入組標準對血常規的要求相對較寬泛可能導致部分基線血常規較低的病人(如I度的WBC減少,II度血小板)也可以入組;3、腹部轉移灶是入組病人的常見轉移部位,其中相當一部分病人合併了肝轉移。
可以說,整個研究的設計、入組流程和治療都非常精準而得當。在這種情況下,獲得一個比較成功的結果也是水到渠成了。
三、關山路遙,鴻雁傳書
本文最大的創新點在於再次為放療的遠隔效應提供了循證依據。全部患者在治療後,遠處有效率高達45%。
所謂遠隔效應,指在進行放療之後,放療野外的,距離原發灶較遠的病灶出現消退或者達到被控制的情況。這一概念的提出,最早可以追溯到1953年。但長期以來,遠隔效應僅限於個案報導,缺乏大宗病例的研究結果。
近年來,基於放射生物中免疫基因的相關研究的進展,對遠隔效應的研究又再次登上了科研熱榜。放療可以誘導免疫原性細胞的死亡,從而誘導主動免疫。當腫瘤被照射時,細胞應激或損傷可能導致腫瘤相關抗原(TAA)從壞死和凋亡的腫瘤細胞和碎片中的釋放出來。TAA數量和多樣性的大幅度增加可以刺激腫瘤特異性的免疫反應。TAA首先被抗原提呈細胞(APC)吞噬,然後呈遞給CD8+T細胞。CD8+T細胞可以識別和攻擊腫瘤細胞。而大劑量分割的SBRT,可以更大程度的誘導免疫微環境的改變,從而提高了遠隔效應發生的可能性。
在遠隔效應的機制逐漸得以闡明的同時,多項研究也對放療聯合免疫治療進行了大膽而成功的嘗試。放療聯合免疫治療通過增加腫瘤內源性T細胞的浸潤,阻斷Treg細胞,增加T細胞克隆的數目等途徑,帶來更為持久的全身免疫治療效果,從而進一步提高了遠隔效應發生的機會。
與此同時,在臨床的觀察和總結中,人們發現,遠隔效應多數發生在免疫原性較強的腫瘤,如腎癌、肝細胞肝癌、惡性黑色素瘤、肺癌等。而有關食管癌的報導甚少。本研究無疑也在這方面增加了前瞻性的依據。
四、包羅萬象,一應俱全
本文立足於食管癌這一我國特色的病種,而研究涉及到了臨床常見而目前又並無行之有效的治療手段的一線治療後複發轉移的病人。在有限的病例數目的基礎上,研究者進行了全面的記錄和分析,包括病人的一般資料、療效、毒副作用、實驗室檢查結果等,其中尤以實驗室檢查方面的分析最為突出。在這其中,文章全面涉及到了淋巴細胞亞群、板淋比、粒淋比、粒單比、淋單比這些操作簡單、檢查方便又是近年熱門的實驗室指標。理論上有免疫相關的支持機制,實踐上有臨床獲益人群篩選的需求。在此全面的分析中,作者最終認為療末CD8+ T細胞以及板淋比可能是療效相關的重要指標。
五、白璧微瑕,瑕不掩瑜
對於本文,也有一些疑問有待作者答疑解惑。
其一,本文主要針對的是複發轉移且非寡轉移的食管癌,且從入組的病人ECOG評分看來,大多數人的一般狀況尚可,對於這部分病人而言,化療和靶向治療等全身治療仍應該佔據主要的位置,但文中沒有述及全身治療在這其中的介入時機、比例以及作用。
其二,在文章的結果中提到,在確切有遠隔效應的病例裡,絕大多數(10/14)是轉移灶少的人群,有4個及以上轉移灶的病人,並未發現有遠隔效應。那麼是否放療加免疫治療的遠隔效應對這部分病人作用有限?或者是否可以考慮Ta1依據不同的瘤負荷給予不同的劑量?
其三,在獲得遠隔效應的人群中,未涉及到這部分病人放療和未放療的轉移灶的位置。因為轉移是個相對寬泛的概念,不同的部位對於局部放療的適應症和療效應當還是有一定的差異。
其四,如前所述,放療本身是可以具有遠隔效應的。本研究由於沒有單純照射組,那麼這種遠隔效應是否真的是Ta1帶來的或者是提升的,仍然有待進一步的商榷。同樣道理,由於缺乏單純藥物組作為對照,亦無法排除「遠隔效應」實為藥物的治療作用。
六、何去何從,始於足下
目前放療聯合免疫治療是國際上的研究熱點。在近期的學術會議上,也該方面的研究結果也是層出不窮,但整體的證據水準都比較有限,且多數研究都在肺癌方面,有關食管癌的報導相對罕見。而作為我國的特色病種,我們也應在此路途上做更多探索,尤其是在SBRT相結合的路線上,對於不同部位、不同的處方劑量以及聯合不同的免疫治療模式方面,我們應該做更多
TAG: |