心血管病風險在輕微腎損傷時就可以存在,在終末期腎病(ESRD)患者中風險最高,並且獨立於其他風險因素。腎功能異常可以改變血脂的水準、組成和品質,易於導致動脈粥樣硬化。現有證據表明,降低低密度脂蛋白膽固醇(LDL-C)有利於預防慢性腎臟病(CKD)患者和腎移植受者中的主要動脈粥樣硬化事件,但對透析患者無益。
改善全球腎臟病預後組織(KDIGO)於2013年發布的《CKD 脂質管理臨床實踐指南》為 CKD 和 ESRD 患者血脂異常的治療提供了簡單的建議。5年來,在 CKD 血脂管理方面有無新的進展?來自英國伯明翰大學的 Charles J. Ferro 教授等人近期在《自然綜述 - 腎臟病學》雜誌上發表了一篇綜述。
要 點
(1)心血管風險與估計腎小球濾過率(eGFR)之間存在獨立的分級負相關關係。ESRD 患者發生心血管事件的風險極高;
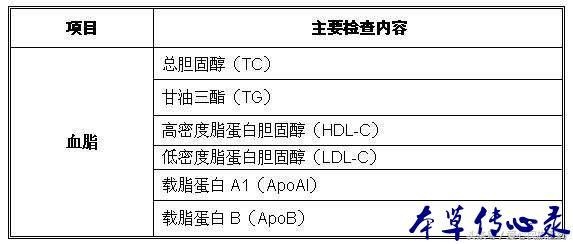
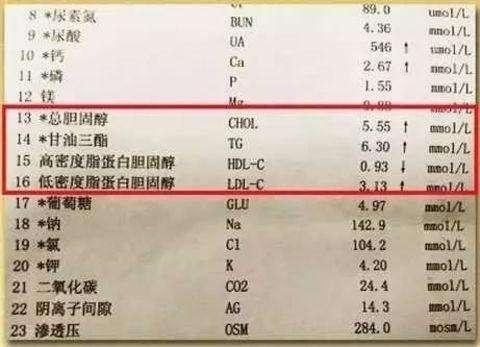
(2)在 CKD 和 ESRD 患者中,脂質代謝紊亂表現為甘油三酯(TG)和氧化脂蛋白水準升高,高密度脂蛋白膽固醇(HDL-C)水準降低,但 LDL-C 水準通常是正常的;
(3)隨著 eGFR 的下降,基於他汀類藥物治療的主要心血管事件的獲益減小,對於透析患者的益處很少;
(4)腎功能惡化導致一種獨特的心血管疾病表型,即心力衰竭和心律失常導致的心血管事件大於由於動脈粥樣硬化導致的事件;
(5)幾種治療血脂異常及其相關風險的新療法正在開發,這些藥劑大多數都是生物製劑,生產成本非常高;
(6)目前支持在 CKD 或 ESRD 患者中使用新型降脂藥物的證據有限,需要進一步研究這些療法。
慢性腎病中脂蛋白代謝的紊亂
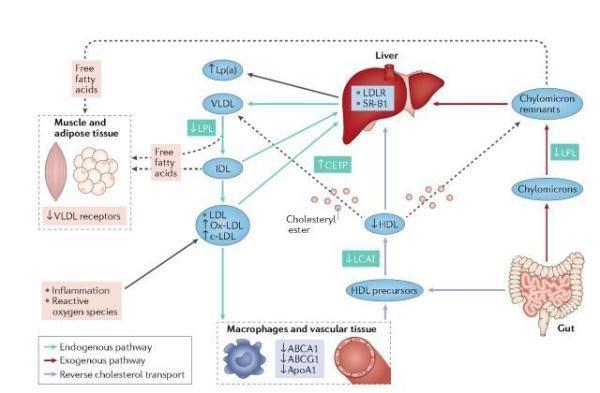
在內源性途徑中,肝臟分泌富含 TG 的極低密度脂蛋白(VLDL)顆粒,其將 TG 轉運至外周組織。由於 TG 被脂蛋白脂肪酶(LPL)水解,VLDL 顆粒的大小減小,成為中密度脂蛋白(IDL)顆粒,最後是 LDL 顆粒,其保留了相當大量的膽固醇。LDL 顆粒將膽固醇轉運至肝臟和外周組織,並被 LDL 受體(LDLR)以及其他特異性受體和清道夫受體如清道夫受體 B1(SR-B1)清除。
在外源途徑中,富含 TG 的乳糜微粒(CM)運輸從腸道吸收的膳食脂質。CM 被 LPL 分解代謝,導致產生由肝臟、肌肉和脂肪組織吸收的遊離脂肪酸。CM 的大小迅速減小,成為通過 LDLR 被肝臟吸收的乳糜微粒殘留物。HDL 顆粒在膽固醇逆向轉運過程中起關鍵作用,膽固醇轉運將膽固醇從外周細胞(包括巨噬細胞和內皮細胞)轉運到肝臟。隨著腎功能下降,朝向尿毒症脂質譜發生逐漸的定量轉變,其特徵在於 TG 升高,低 HDL-C 和可變水準的氧化 LDL(ox-LDL)和氨基甲醯化 LDL(c-LDL)膽固醇。脂質譜還通過包括糖尿病和腎病綜合征在內的合併症進一步修飾。與定量變化平行,脂蛋白顆粒的主要定性變化也使其更致動脈粥樣硬化,包括氧化增加。
新興的脂質修飾療法
綜述中除了介紹他汀類、貝特類(纖維酸類)、膽酸結合劑、以及歐米伽 -3- 脂肪酸對於血脂紊亂的治療,還重點總結介紹了新興的降脂治療方法。

KDIGO指南的修訂建議

其他指南對於血脂治療的建議

參考文獻
Lipid management in patients with chronic kidney disease. Nature Reviews Nephrologyvolume 14, pages727–749 (2018)
編輯 | 徐德宇
版權聲明:如涉及版權問題,請作者持權屬證明與本網聯繫
來源:腎內時間