▎葯明康德/報導
今日,百時美施貴寶公司(Bristol-Myers Squibb,BMS)宣布,美國FDA已經接受Opdivo(nivolumab)和低劑量Yervoy(ipilimumab)的補充生物製劑許可申請(sBLA) ,一線治療腫瘤突變負荷(TMB)≥10個突變/兆鹼基(mut/Mb)的晚期非小細胞肺癌(NSCLC)患者。FDA的目標行動日期為2019年2月20日。

根據世界衛生組織(WHO)的報告,肺癌是全球癌症死亡的主要原因,每年導致近170萬人死亡。據估計,今年美國將有超過23.4萬例肺癌新診斷病例,並且這種疾病將導致超過15.4萬人死亡,幾乎佔所有癌症死亡的四分之一。NSCLC是最常見的肺癌類型之一,約佔85%。在所有肺癌中,約25%至30%是鱗狀細胞癌,而非鱗狀NSCLC約佔50%至65%。肺癌的生存率取決於診斷時癌症的分期和類型。對於診斷為轉移性肺癌的患者,5年生存率低於5%。
隨著時間的推移,癌細胞會在正常細胞中積累不可見的突變。腫瘤突變負荷(TMB)是反映腫瘤細胞攜帶的突變總數的定量生物標誌物。具有高TMB的腫瘤細胞具有更高水準的新抗原,這被認為有助於免疫系統識別腫瘤,並激發抗癌T細胞的增加和抗腫瘤應答。TMB可能可以幫助預測患者對免疫療法的反應。
Opdivo是世界上首個獲得批準的PD-1免疫檢查點抑製劑,該藥物目前已在包括美國、歐盟和日本等60多個國家與地區獲得批準。Opdivo和Yervoy聯合用藥方案成為首個獲得批準治療轉移性黑色素瘤的聯合免疫療法,該聯合療法目前已獲得包括美國和歐盟在內的50多個國家的批準。

此次sBLA的申請提交是基於CheckMate -227研究第1部分的結果,這項全球3期臨床研究評估I-O/I-O方案與化療方案相比,在TMB≥10 mut/Mb的NSCLC患者一線治療中的療效,跨越鱗狀和非鱗狀腫瘤組織學以及PD-L1表達譜。這些數據在今年舉行的美國癌症研究協會(AACR)年會上得到公布,並在《新英格蘭醫學雜誌》上發表。
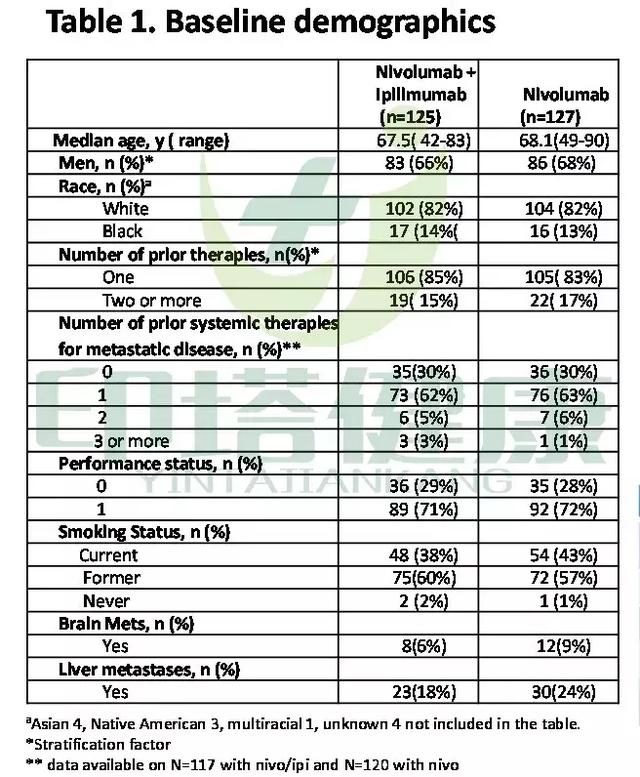
CheckMate -227是一項正在進行的多部分、開放標籤、全球3期臨床試驗,用於評估Opdivo方案與鉑雙聯化療相比,一線治療鱗狀和非鱗狀腫瘤組織學的晚期NSCLC患者的療效。第1部分有兩個共同主要終點:腫瘤表達PD-L1的患者的總生存期(OS)和腫瘤跨越PD-L1譜的TMB≥10mut/Mb的患者的無進展生存(PFS)。TMB狀態由經過驗證的測定FoundationOne CDx評估。Opdivo和Yervoy在本研究中的劑量為:每兩周使用Opdivo 3 mg/kg,每六周使用低劑量Yervoy 1 mg/kg)。
結果顯示,Opdivo加低劑量Yervoy聯合療法表現出相比化療更優秀的PFS主要終點,將疾病進展或死亡風險降低42%(HR 0.58; 97.5%CI: 0.41-0.81; p=0.0002)。該PFS益處在鱗狀和非鱗狀腫瘤組織學中均能觀察到,且無論PD-L1的表達水準如何。此外,基於早期描述性分析,在高TMB患者中,該聯合療法也顯示出相比化療更優秀的OS結果(HR 0.79; 95%CI:0.56-1.10)。

▲BMS處於中後期階段或已上市的抗腫瘤藥物(圖片來源:BMS官方網站)
BMS胸部癌症研發負責人Sabine Maier博士評價說:「肺癌是一種複雜的疾病,我們相信需要多種治療方法,包括生物標誌物驅動的治療方法來幫助個體患者。我們期待在整個審查過程中與FDA合作,為患者提供這種重要的治療選擇。」