不想錯過界哥的推送?

今天給大家送上中山大學腫瘤防治中心的蔡修宇教授總結的,美國臨床腫瘤學會年會(ASCO 2019)非小細胞肺癌(NSCLC)免疫治療進展局部晚期治療篇。之後兩天將送上晚期治療和療效預測的內容,敬請關注哦~(傳送門→新輔助治療)
局部晚期治療
Pacific研究開創了局晚期NSCLC患者同步放化療後,免疫鞏固治療的新標準,將免疫治療獲益人群大大提前,而今年ASCO也讓我們看到了免疫治療聯合約步放化療或是新思路。
▍1、PACIFIC:局晚期NSCLC患者Durvalumab輔助治療3年總生存(OS)率達到57%(ab8526)
PACIFIC研究是在不可切除Ⅲ期NSCLC同步放化療的基礎上,將治療後未出現疾病進展的患者隨機分為2組,第一組接受Durvalumab鞏固治療一年,第二組接受安慰劑,旨在觀察患者接受Durvalumab鞏固治療後,能否提高無進展生存(PFS)和OS。2018年歐洲腫瘤內科學會(ESMO)大會上更新了該研究的中位PFS和2年生存數據,mPFS為16.8月 vs 5.6月(HR 0.52),2年OS率為66.3% vs 55.3%(HR 0.68),mOS為NR(未達到) vs 28.7月。

圖1 研究設計

圖2 ESMO大會上公布的PFS和OS數據
本次ASCO會議展示了3年的OS更新數據。中位隨訪時間33.3個月,治療組的中位OS較安慰劑組明顯延長,為NR vs 29.1月。兩組3年OS率分別為57% vs 43.5%,這意味著超過半數的局晚期患者活過了3年,與安慰劑相比多出了13.5%的存活患者。
表1 ASCO會議展示了3年的OS更新數據

除了生存時間的明顯延長,治療組的治療效果持續時間也更長。相比安慰劑組,治療組患者接受後線治療或死亡的時間得到延長,其中接受第1次後續治療時間增加了一倍(21.2月 vs 10.4月),接受第2次後續治療時間為30.2月 vs 17.8月。

圖3 接受第1次和第2次後續治療時間
PACIFIC研究證明,通過Durvalumab的鞏固治療,可大幅度提高不可切除Ⅲ期NSCLC患者的整體生存率,讓我們對5年生存數據更加期待。
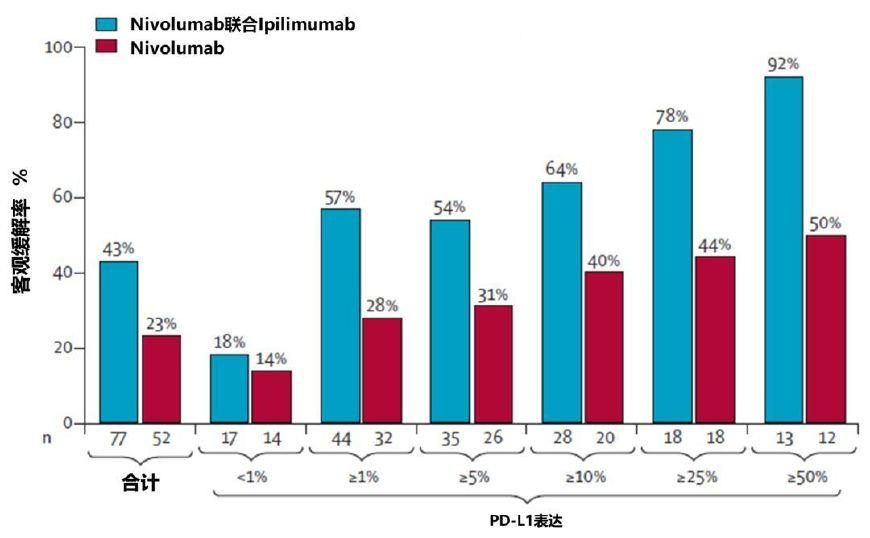
▍2、LUN16-081:對不可切除的IIIA/IIIB期NSCLC同步放化療後,聯合使用納武利尤單抗和Ipilimumab與單獨使用納武利尤單抗的比較(ab8535)
這是一項比較聯合使用納武利尤單抗和Ipilimumab與單獨使用納武利尤單抗在IIIA/IIIB期NSCLC患者同步放化療後安全性的隨機對照研究。105例患接受標準同步放化療後,按1:1分配至納武利尤單抗480mg q4w組和納武利尤單抗3mg/kg q2w +Ipilimumab 1 mg/kg q6w組,療程最長為24周。目前評估了前20例接受治療的患者的安全性。其中納武利尤單抗組10例,中位年齡62歲,IIIA/B 7/3例,非鱗狀/鱗狀細胞癌7/3例;納武利尤單抗/Ipilimumab組10例,中位年齡61歲,IIIA/B 6/4例,非鱗狀/鱗狀細胞7/3例。
表2 兩組患者特徵
結果顯示:毒性反應主要為1級或2級。最常見的2級AE包括疲勞(25%)、肺炎(25%)、肢體疼痛(20%)。納武利尤單抗組報告了4例3級事件和1例4級血栓栓塞事件。納武利尤單抗/Ipilimumab組報告了3例3級事件和1例4級毒性(澱粉酶升高)。在免疫相關不良事件(irAEs)方面,納武利尤單抗組有2例發生2級肺炎,沒有發生3/4級肺炎。納武利尤單抗/Ipilimumab組2級肺炎1例,3級irAE(肺炎、結腸炎、胰腺炎)3例,無癥狀的4級澱粉酶升高1例。兩組均未發現與治療相關的死亡。
結論:在本研究的前20例患者中,沒有不可預期的不良反應。3級或更高的irAEs的發生率在納武利尤單抗/Ipilimumab組中較高。
表3:兩組不良反應

▍3、Atezolizumab聯合約步放化療治療局晚期NSCLC安全性良好(ab8512)
Pacific研究奠定了局晚期患者免疫鞏固治療的標準後,本研究期望在同步放化療(CCRT)的同時加用免疫治療可以提高療效,且不會產生明顯的附加毒性。
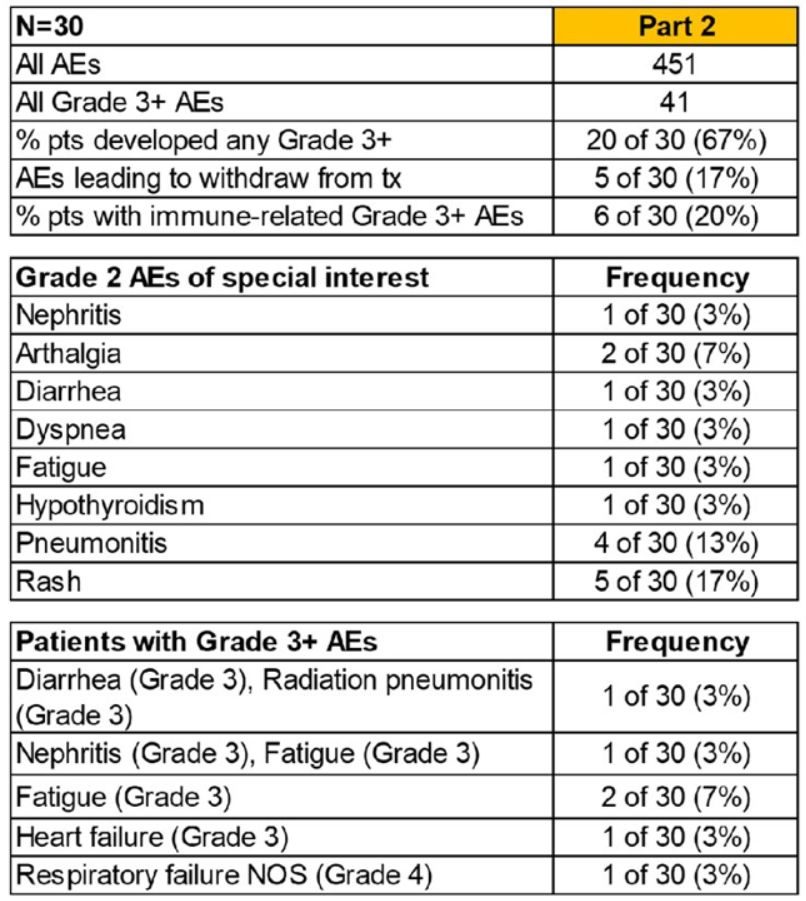
研究兩部分進行:第1部分(N=10),常規分割放化療(CRT)(60-66Gy,30-33次,每周低劑量卡鉑+紫杉醇周療),然後進行CP-Atezolizumab,接著Atezolizumab維持。第二部分為CCRT(N=30),先用Atezolizumab,後加CP-Atezolizumab,再用Atezolizumab維持。Atezolizumab使用劑量為1200mg q3w。嚴重不良事件(SAE)由CTCAE v5.0定義。PD-L1染色採用DAKO 22C3平台。Kaplan-Meier分析PFS和OS,並對PD-L1在任何複發時的水準進行卡方檢驗,顯著性設置為0.05。
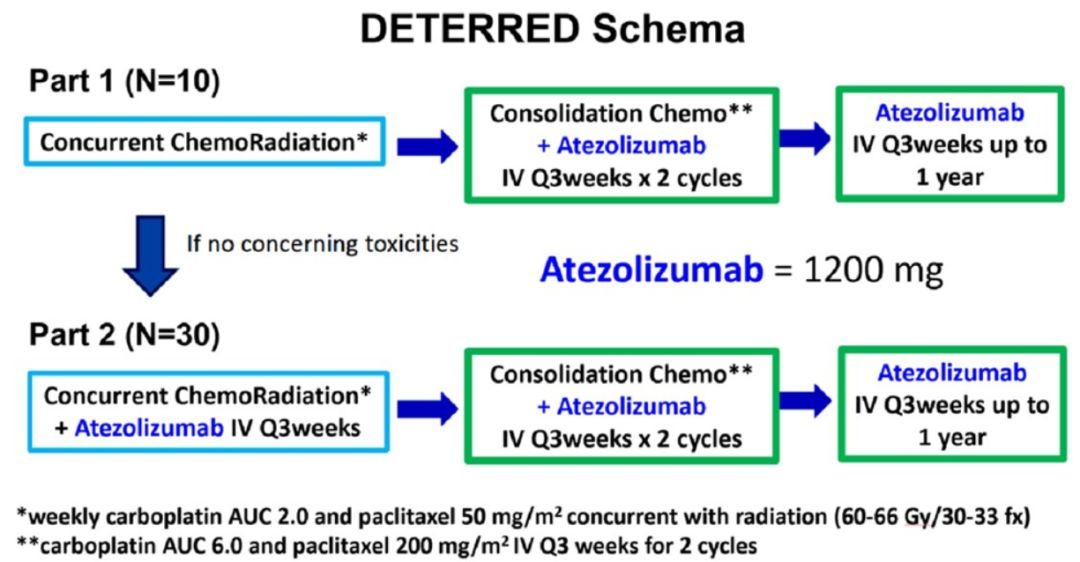
圖4 研究設計
結果:在第一部分中,4例(40%)出現與疼痛相關的SAE(2例為3級關節痛,1例為3級呼吸困難,1例為5級TE瘺),2級放射性肺炎(RP)1例。在第二部分中,有7例(23%)與SAE相關(腹瀉、腎炎、呼吸困難、疲勞和心力衰竭)。3例發生放射性肺炎(RP),其中2例為2級,1例為3級。
表4 第一部分不良事件
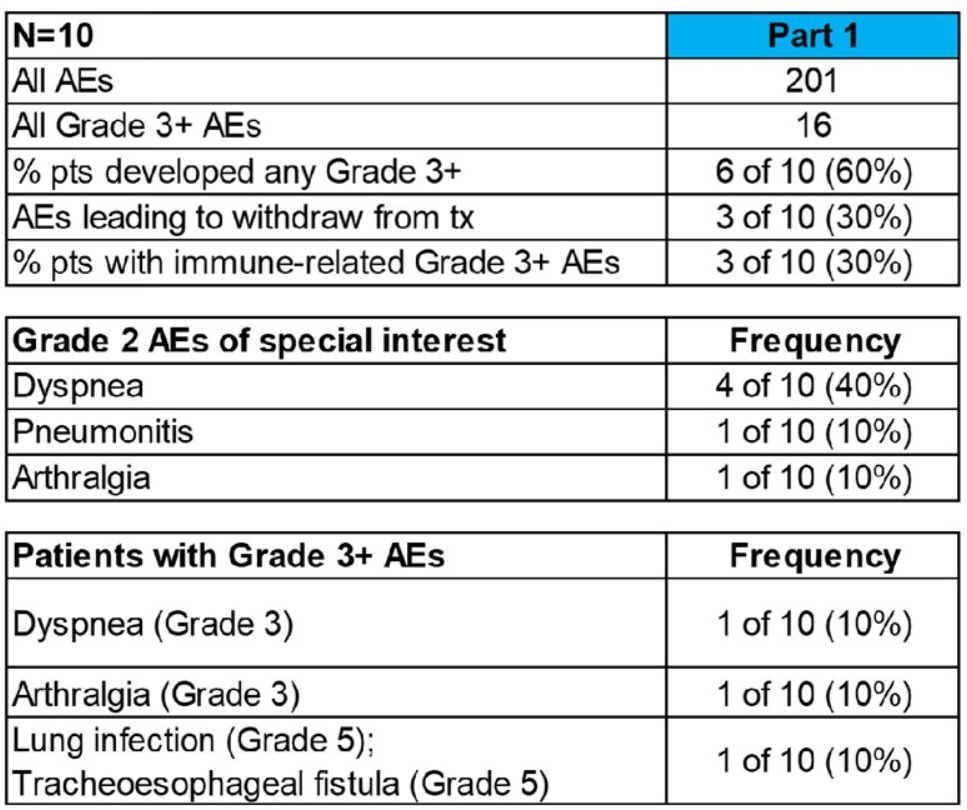
表5 第二部分不良事件
在第一部分中,1年PFS為50%,OS為79%。在第二部分中, 1年PFS為57%,OS為79%。

圖5 PFS結果

圖6 OS結果
34例患者基礎腫瘤組織活檢PD-L1狀態可評估,腫瘤複發率與PD-L1的表達水準沒有明顯相關性(P>0.05)。

圖7 腫瘤複發率與PD-L1的表達水準沒有明顯相關性
結論:與單純CRT、CP-Atezolizumab和Atezolizumab維持治療的序貫模式相比,同時接受CRT、CP-Atezolizumab和Atezolizumab治療是安全的,且毒性不會增加。
▍4、局晚期不可切NSCLC患者帕博利珠單抗聯合約步放化療PFS獲益明顯(ab8511)
這是一項評估帕博利珠單抗+化療(卡鉑+紫杉醇周療)聯合根治性放療(60Gy/30fx)用於不可切局部晚期NSCLC的有效性和安全性的I期前瞻性臨床研究,研究採用3+3設計,設置了5組帕博利珠單抗劑量組(C1-C5)。C1:CRT後2-6周予以全劑量(200mg q3w),C2:CRT後第29天予以減劑量100mg q3w,C3:CRT後第29天予以全劑量,C4:CRT第1天予以減劑量,C5:CRT第1天予以全劑量。每組帕博利珠單抗持續治療3周,最多18個周期。劑量依賴性毒性(DLT)定義為使用帕博利珠單抗第1周期後21天內發生的?4級肺炎。
研究共招募了23例患者。在任一劑量組(C1-C5)中均未觀察到DLT。4例患者(18%)發生了?3級免疫相關不良事件(irAE),包括:5級(雙側)、3級、2級肺炎(分別為1例、1例、4例),3級高血糖(1例),3級間質性腎炎(1例),2級甲狀腺炎(4例),2級肌炎(1例),以及1-2級轉氨酶升高(3例)。接受?2次帕博利珠單抗治療患者(18例)的中位PFS為20.3個月。
該研究認為,帕博利珠單抗聯合約步放化療治療對於III期NSCLC的耐受性良好,PFS獲益明顯,但免疫相關不良事件,特別是肺炎的風險有所增加。

蔡修宇教授
蔡修宇,中山大學腫瘤防治中心副主任醫師,副教授,腫瘤學博士,碩士生導師。學會任職:美國臨床腫瘤學會(ASCO)會員、歐洲腫瘤內科學會(ESMO)會員、國際肺癌研究協會(IASLC)會員、中國臨床腫瘤青年委員會(CSCO Young)常委、CSCO免疫治療專家委員會委員、CSCO智慧醫療專家委員會委員、中國抗癌協會腫瘤臨床化療專業委員會常委、中國抗癌協會腫瘤標誌專業委員會委員、中華醫學會心血管病學分會腫瘤心臟病學學組委員、廣州市中青年腫瘤醫師論壇主席、廣州市抗癌協會腫瘤複發與轉移委員會主任委員、廣東省胸部疾病學會免疫治療專業委員會候任主任委員、廣東省健康管理學會腫瘤防治專業委員會常委、廣東省健康管理學會胸部腫瘤及肺結節管理專業委員會常委、廣東省保健協會腫瘤防治專業委員會秘書長。
本文首發:醫學界腫瘤頻道
本文作者:蔡修宇 中山大學腫瘤防治中心
責任編輯:Sharon
Hi 醫生朋友們
最近中藥注射劑的話題有關注嗎?
我們誠邀您參與有獎調研
您的想法和選擇對我們來說很重要
您也有機會獲得小禮品
「閱讀原文」
或識別下方海報內二維碼開始吧~
征 稿請註明:【投稿】醫院+科室+姓名
來稿以word文檔形式,其他不予考慮
你在看我嗎?
↓↓↓↓