為了盡早為臨床醫生和患者帶來創新療法,全球生物製藥公司在過去已經開發出許多新機制B肝候選藥物,並將它們轉化至臨床試驗概念驗證階段。在舊機制基礎上有所創新的是一種新型活性位點聚合酶抑製劑核苷酸——ATI-2173,也有更多的FXR激動劑被開發轉化至對CHB的臨床試驗。
來自Replicor公司對NAPs作用機制描述

B肝RNAi或ASO,實現HBsAg降低機制存誤解,來自Vaillant博士剖析
剛剛在新加坡舉行的“治愈HBV”科學會議上,生物製藥公司Replicor的安德魯·威蘭特博士(Andrew Vaillant)不僅描述了已經推向臨床研究中的 I類和II類衣殼組裝調節劑作用機制和開發前景,也針對自身管道特點和其他新機制,包括RNAi進行剖析。
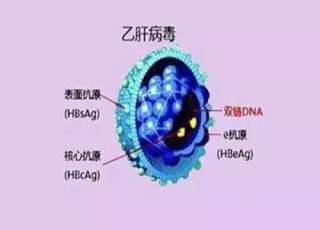
威蘭特博士認為,核酸聚合物(NAPs)對循環中的B肝表面抗原(HBsAg)產生的影響,主要歸因於它們能夠選擇性地靶向 HBV 亞病毒顆粒(SVP)的組裝和分泌,這些顆粒構成循環中HBsAg比例>99.99%。這種新型抗病毒療法(指NAPs)的作用機制,最近在臨床研究中得到驗證,在 NAP 治療期間,HBsAg的小異構體被選擇性清除,這是對 SVP靶向的診斷。重要的是,NAPs對 Dane 顆粒或 HBeAg 的產生和或釋放沒有影響。
由於 SVP 對 HBsAg庫的貢獻,定量 HBsAg 與肝內cccDNA即使在 HBeAg陽性受試者中,也沒有很好的相關性。SVPs由活性cccDNA和整合的 HBVDNA產生。整合是慢性HBV感染自然進展的早期和累積事件。HBeAg陽性感染中,存在HBVDNA整合,儘管其水準低於 HBeAg 陰性感染。

HBsAg丟失的目標,必須包括有效去除 SVP。在這方面,關於在使用旨在靶向 HBV mRNA降解的 RNAi 或 ASO 化合物治療期間,實現 HBsAg 降低的機制,威蘭特博士認為,這仍然存在一些基本誤解。HBV感染具有非常高的遺傳可塑性(任何特定受試者中存在數千個準種),這是由於 HBV 逆轉錄酶缺乏校對活性、cccDNA的快速更新和持續的免疫壓力造成的。
相關B肝候選藥物作用於B肝病毒,鑒於單點突變消除了 RNAi 或 ASO 靶向特定 mRNA切割的能力,考慮 RNAi 或 ASO方法的理論基礎尚不清楚。
ARB-1467研發失敗證實了這一點(由Arbutus Bio公司研發RNA干擾候選藥物,又名TKM-HBV;在ARB-1467失敗基礎上,Arbutus Bio開發了下一代RNAi候選藥物AB-729) ,這是一種 LNP 配置的 RNAi,具有三種 siRNA觸發物;兩種在 HBsAg 中,一種在 HBx中(因此涵蓋cccDNA和整合的HBVDNA)。siRNA和 LNP製劑是最有效的 RNAi 化合物遞送方法,導致 RNAi化合物的功能性攝取,僅在肝細胞中。
在經核苷(酸)類似物(NUC)治療抑製的慢性HBV感染中,ARB-1467對B肝表面抗原的影響很小,重要的是,治療期間 HBVDNA和 HBcrAg最初輕度下降後迅速反彈。此外,最近的一項 HBsAg 同工型分析(使用與評估NAP相同的分析平台)在使用 AB-729 和 HBx 中的 GalNAc綴合的單一RNAi觸發劑治療期間,顯示沒有靶向SVP,而是反向選擇性地靶向病毒體。
Replicor公司的威蘭特博士認為,從上述這兩個觀察到的結果,都排除了mRNA降解設計用於慢性HBV感染的 RNAi 或 ASO的化合物降低 HBsAg的潛在機制。

小番健康結語:在最近一次科學會議上,總體上,Replicor的威蘭特博士在論述如HBV衣殼組裝調節劑、RNAiB肝候選藥物已公布的臨床前和臨床開發數據中認為,了解各種研究藥物之間的機制、優勢和局限性,對設計最佳組合至關重要!因為最佳方案有可能實現有限治療和更高的功能性治愈率。
在下一章,會介紹除HBV衣殼組裝調節劑和RNAi外,與RNAi作用機制近似的ASO,代表候選藥物 Bepirovirsen(英國葛蘭素史克公司研發,GSK836),它在以往臨床開發中可調降B肝表面抗原水準的機制是什麽?該觀點也是由Replicor公司的威蘭特博士在新加坡舉行的科學會議上公布出來。因為內容比較多,我們分為針對HBV衣殼組裝調節劑、RNAi和ASO三篇單獨介紹。返回搜狐,查看更多
責任編輯: