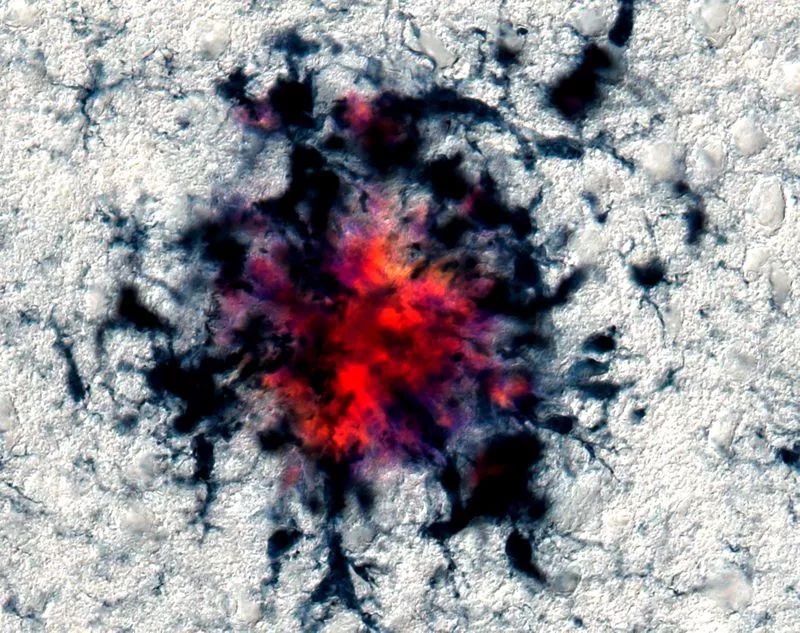
就像珍珠裡的砂礫一樣,ASC斑點是澱粉樣蛋白沉積的種子。靶向ASC斑點形成的藥物,提供了一種新的治療方法。
在大腦中,可溶性澱粉樣蛋白β肽的聚集及其後續沉積成塊(稱為斑塊)在阿爾茨海默病中發揮關鍵作用。
A:在小膠質細胞中,可溶性澱粉樣蛋白β聚集物可以觸發炎症蛋白質前體的形成,如pro-IL-1β。
B:隨著病情進展,細胞受損,所釋放出的產物可以觸發一種叫做炎性小體的促炎蛋白複合物。
C:炎性小體裂解pro-IL-1β產生蛋白質IL-1β,後者在大腦中被釋放,並引發炎症。小膠質細胞也釋放一種叫做ASC斑點的ASC蛋白複合物(ASC是炎性小體的組成部分)。
Venegas等人證實,在小鼠中,ASC斑點與澱粉樣蛋白β聚集物發生相互作用,促進斑塊的沉積。
阿爾茨海默病:既簡單,又複雜
從某種角度來看,阿爾茨海默病其實可以被認為是一種相對簡單的疾病:它需要聚集β-澱粉樣蛋白形成斑塊,引發下遊一系列的後果,最終導致癡呆。
但是,當把所有的因素都考慮在內時,這種病又是非常複雜的。例如,炎症過程在其中發揮了某些作用。阿爾茨海默病有許多異常炎症指標:免疫分子水準升高;被稱為膠質細胞的神經支持細胞對異常的組織環境反應強烈;血腦屏障的特殊脈管系統也發生了變化。
儘管有這些證據,但關於炎症是如何促進該病的細節卻一直很模糊。德國波恩大學的Venegas等人開展了一項新研究,結果表明,在小鼠中,一種細胞外的免疫激活蛋白促進了β-澱粉樣蛋白的聚集。
澱粉樣蛋白聚集,形成了澱粉樣斑塊,但具體機制仍不清楚
β-澱粉樣蛋白來自一種更大的蛋白質——澱粉樣前體蛋白(amyloid precursor protein,APP),後者裂解產生了一系列的短肽。阿爾茨海默病可以由APP或處理它的酶的突變直接引起,如果由此產生的β-澱粉樣蛋白形成了聚集物,則會出現集簇性的細胞損傷。這些可溶性澱粉樣蛋白聚集物隨後進一步聚集,並以團塊(稱為澱粉樣斑塊)的形式沉積在腦組織中。然而,斑塊形成的具體機制仍不是非常清楚。
新通路:NLRP3-炎性小體-ASC斑點
Venegas等人既往觀察到,小鼠缺乏蛋白質NLRP3有防止β-澱粉樣蛋白沉積的作用。NLRP3是一種免疫感測器,存在於中樞神經系統中被稱為小膠質細胞的免疫細胞中,其可檢測異常的生化物質,包括受損細胞的產物,並引發一種叫做炎性小體(inflammasome)的細胞內蛋白質複合物的形成。該複合物包含NLRP3、凋亡相關的斑點樣蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和一種叫做caspase-1的酶。該炎性小體的功能是使細胞釋放已形成的促炎蛋白質——白介素-1β(interleukin-1β,IL-1β)和IL-18,這些白介素的產生是為了應對早期炎症信號——在阿爾茨海默病的情況下,是為了應對可溶性的β-澱粉樣蛋白。

在細胞內炎性小體形成後,細胞釋放出ASC複合物,稱為ASC斑點(specks)。在許多非免疫細胞中,ASC斑點的釋放伴隨著細胞死亡,但在包括小膠質細胞在內的免疫細胞中,細胞通常能更好地耐受ASC斑點的釋放,並藉此傳播炎症——這可能是因為ASC斑點被鄰近的小膠質細胞吸收,以介導進一步的白介素釋放。
Venegas及其同事的數據提供了有力的事實論據:ASC斑點有助於促進β-澱粉樣蛋白在小鼠中沉積。這些實驗是具有挑戰性的,因為ASC蛋白和β-澱粉樣蛋白不僅本身容易聚集,而且還易於與其他蛋白質聚集。不過,研究人員謹慎地使用對照,使他們能夠證明,其所報告的現象反映了具有生物學意義的相互作用,而不是非特異性的聚集。
目前,影響阿爾茨海默病易感性的基因特徵與NLRP3-炎性小體-ASC斑點通路之間,並沒有確切的聯繫。如果發現二者確有關聯,將有助於指導未來的工作。然而,在小鼠中,炎性小體的活動似乎可以通過引起與衰老和中年肥胖相關的低水準炎症(包括全身炎症和中樞神經系統炎症),在多個層面上促進大腦衰老。
治療:靶向通路的上遊,還是下遊
如果由此衍生的療法是有效的,那麼確定哪一部分的通路可以做為靶標是很重要的。抑製這一通路的上遊部分,如NLRP3介導的炎性小體形成,將產生更廣泛的影響,但也有損害宿主防禦的潛在風險。相比之下,靶向這一通路的下遊部分——例如,選擇性地抑製大腦中ASC斑點的形成——將更加具有特異性,但可能不足以抑製與阿爾茨海默病相關的多種致病機制。儘管有這樣那樣的困難,但有一個新發現的機制來指導阿爾茨海默病的治療還是令人振奮和鼓舞的。
薦
讀