腫瘤免疫療法的火熱,極大程度地推動了人們征服癌症的步伐。這眼瞅著形勢一片大好,可誰知腫瘤免疫療法的時常會抽風失靈,著實令人頭疼。到底誰才是腫瘤免疫療法掣肘的真正主謀,科研界裡也是眾說紛紜。
而腸道微生物作為人類的「第二基因組」,其結構、組成和狀態均與宿主健康息息相關,想來腸道菌群若是與免疫療法迎面相撞,必然也能擦出新的抗癌火花。這不,近日裡《Science》專刊也連續推出幾篇重磅文章強勢指出,腫瘤免疫療法靈不靈,那得看腸道微生物的「臉色」。
微生物與癌症治療間的免疫橋樑
2013年,美國家癌症研究所Romina Goldszmid和 Giorgio Trinchieri就發現,在癌症治療前一旦以重劑量抗生素處理患癌老鼠,或者是以無菌的患癌小鼠為模型,則免疫治療或鉑類藥物的治療效果明顯變差。
同年,法國國家健康與醫學研究院的 Laurence Zitvogel研究團隊同樣以長期接受化療的患癌老鼠為研究對象,人為干擾老鼠微生物平衡後,得到了癌症治療效果降低的類似結果。
顯然,微生物與癌症治療之間的橋樑在於免疫系統,腸道微生物(至少在老鼠體內)可顯著影響免疫系統對付癌症的能力,而抗癌藥物只有在擁有正常腸道微生物的生物體內才能更有效地駕馭個體的抗腫瘤免疫力。
微生物「初識」免疫治療,開闢抗癌新思路
現今免疫檢查點抑製劑(PD-1/CTLA4)已成為了抗癌的排頭兵,雖然它們曾讓腫瘤細胞潰不成軍,但它們仍然不是戰勝癌症的最終福音,因為該療法只能對約25%的患者起效。
針對此現象,法國Gustave-Roussy 癌症研究所的Laurence Zitvogel研究團隊於2015年試圖探究腸道微生物是否對檢查點抑製劑藥物具有同樣的效果。結果發現,抗生素處理或者無菌小鼠無法對CTLA-4抑製劑產生反應,而口服多形擬桿菌、脆弱擬桿菌則可以恢復這些小鼠對於CTLA-4抑製劑的治療效果。
無獨有偶,芝加哥大學的另一項研究也發現黑色素瘤模型小鼠腸道定植的菌群不同,黑色素瘤生長情況不同。小鼠腸道中雙歧桿菌屬中一些特定種(如短雙歧桿菌、長雙歧桿菌和青春雙歧桿菌)的存在會通過增加CD8+ T細胞數量來增強PDL1抗體的抗癌效果。
不過因為上述研究還是在小鼠身上進行的,不少科學家對此結果仍然是將信將疑。但這還僅僅是免疫療法與腸道微生物的初次相遇,它們之間的羈絆遠遠不止於此。
再遇微生物,免疫療法威力盡顯
時隔兩年,2017年《Science》期刊再次上線了三項重磅研究,研究者通過對接受過PD-1抑製劑治療的不同癌症類型的患者進行大規模分析,證明了腸道微生物在免疫治療中確實起著決定性作用。
上文提到的法國研究團隊則分析了249名接受了抗PD-1免疫治療的肺癌、腎癌、膀胱癌等多種上皮性腫瘤患者的臨床數據,其中有69名患者在接受免疫治療開始前或剛開始時使用了抗生素(對抗各種感染),包括醯胺類、喹諾酮類和大環內酯類。
經過長期跟蹤隨訪發現,這69位患者的中位生存時間顯著縮短。顯然,使用廣譜抗生素而造成的人體腸道菌群的紊亂,會極大程度降低了PD-1抑製劑的藥效。


而進一步研究發現那些無法從免疫療法獲益的患者,體內一種有助於脂肪燃燒並改造血糖程度、有望為改善肥胖和糖尿病患者代謝情況的Akkermansia muciniphila(簡稱Akk菌)菌群豐度很低,相反存在該菌群的患者在接受免疫治療後癥狀得到了緩解。
另外,小鼠的「糞便移植」實驗所得到的結果與實際患者一致,移植AKK菌後的小鼠對免疫治療可產生較好的應答反應,而且對PD-1抑製劑治療反應不佳的小鼠也可以通過餵養AKK菌來轉化為應答者。
細究其原因,可能與Akk菌和希拉腸球菌等微生物誘導樹突細胞釋放炎性介質白介素-12(IL-12),從而募集更多的CD4+T細胞集中到腫瘤周圍有關,T細胞的聚集可增強機體的抗腫瘤能力。

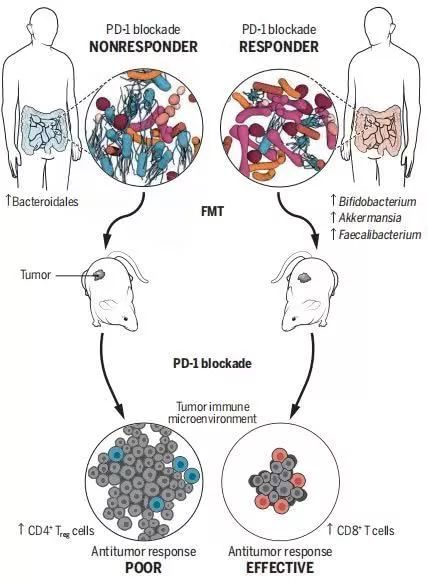
而另外兩篇文章則聚焦黑色素瘤,同樣也印證了腸道微生物在免疫治療的巨大價值。黑色素瘤是西方國家最常見的腫瘤之一,也是PD-1抑製劑最早涉及和獲批的適應症之一。
其中,MD 安德森癌症中心的J. A. Wargo教授則以112例接受抗PD- 1免疫療法的致命性皮膚癌-晚期黑色素患者為研究對象,通過16S RNA與全基因組測序,統計了患者糞便樣品和口腔拭子中腸道菌群的多樣性、組成和功能潛力。
結果發現具有更高的腸道細菌多樣性的患者擁有更長的中位無進展生存期(progression-free survival,PFS);且對PD-1免疫療法有反應的30 名患者其菌群的組成以及多樣性均和無反應的13位患者有著顯著不同,療效好的患者腸道中瘤胃球菌(Ruminococcaceae)的細菌豐度更高。


而採用基因組學方法進行的功能分析也顯示,患者治療效果的差異與不同微生物影響了腸道內的氨基酸合成、對機體CD8+T細胞的募集等功能和機制,從而影響機體免疫力有關,這些結果也同樣得到了腸道微生物移植試驗的驗證。
此項研究也有著類似的設計,芝加哥大學的 Thomas F. Gajewski教授的研究團隊在轉移性黑色素瘤患者接受免疫療法前,研究人員們檢查了他們的糞便樣品,並用16S核糖體RNA測序、宏基因組測序、以及定量PCR的技術,對特定菌類進行了分析。
結果發現免疫療法效果良好的患者體內,Bifidobacterium longum、Collinsella aerofaciens、以及Enterococcus faecium都更為豐富。而接受了這些細菌的小鼠對腫瘤有著更好的控制,T細胞反應更強,免疫療法的效果也更好。
顯然,腸道菌群就像一個巨大的寶藏,不知道當下次腸道菌群再次遇到免疫治療時,又能帶給我們怎樣的驚喜。對此,佛羅裡達大學Christian Jobin教授則認為微生物組是尋找下一代新葯的寶庫。微生物組與免疫療法強強聯手後所誕生的新的腫瘤治療方法——腫瘤腸道菌群免疫療法,定會為為腫瘤精準醫療的發展提供更多助力。
1. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti–PD-L1 efficacy.(DOI:10.1126/science.aac4255)
2. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota(DOI:10.1126/science.aad1329)
3. Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors(DOI: 10.1126/science.aan3706)
4. Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients(doi:10.1126/science.aan4236 )
5. The commensal microbiome is associated with anti–PD-1 efficacy in metastatic melanoma patients(DOI: 10.1126/science.aao3290)
6. Precision medicine using microbiota(DOI: 10.1126/science.aar2946)