以PD-1/PD-L1抗體為代表的免疫檢查點抑製劑已經徹底改變了癌症治療。一些先前無法醫治的惡性腫瘤患者接受這類藥物治療後正在經歷長期緩解。然而,儘管療效令人振奮,但只有20%的患者能夠長期響應PD-1/PD-L1抗體;此外,PD-1/PD-L1抗體對某些癌症的治療效果要比其它癌症好得多。是什麼原因導致了這些現象讓科學家們困惑不已。
4月4日,發表在Cell雜誌上的一篇論文中,來自加州大學舊金山分校(UCSF)的科學家們獲得一個驚人的發現:一些看起來PD-L1水準很低的腫瘤其實偷偷將大量的PD-L1送到免疫系統的大本營,這些遠走他鄉的PD-L1遠程抑製了抗腫瘤免疫反應。
領導該研究的泌尿學教授Robert Blelloch博士說:「患者對免疫檢查點抑製劑的響應因癌種不同而大不相同。不過,即便在最好的情況下,如黑色素瘤,也只有20%-30%的患者響應這類藥物;而在攝護腺癌中,響應免疫檢查點抑製劑的患者比例不到10%。這意味著,大多數患者對這種免疫治療無響應。為什麼會這樣呢?我們想知道原因。」
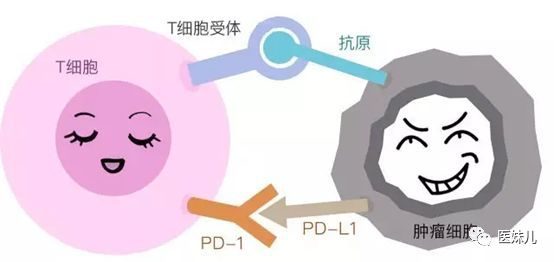
在人體免疫系統中,T細胞是保衛健康的重要士兵。當識別出癌細胞,它們就會發起攻擊。而癌細胞為了躲避攻擊,在其表面表達了一種起著「隱形鬥篷」作用的蛋白質,即PD-L1。當PD-L1與T細胞表面表達的PD-1蛋白相結合後,T細胞就會將癌細胞錯認為正常細胞,並放任它們在體內「發展壯大」。也正是藉助這一機制,癌細胞躲過了免疫系統的攻擊。
PD-1/PD-L1抗體之所以能抗癌,就是通過阻斷PD-L1和PD-1之間的相互作用。「隱形鬥篷」一旦失效,癌細胞就無處躲藏,從而可被免疫系統識別並消滅。
一些腫瘤對PD-1/PD-L1抗體產生耐藥性的一個原因是,它們並不表達PD-L1。此前,已有研究證明,在攝護腺癌患者的腫瘤細胞中,PD-L1蛋白水準較低或者完全缺失,這可能解釋了為什麼這類患者對PD-1/PD-L1抗體響應率非常低。
然而,在最新發表的這篇論文中,Blelloch教授團隊獲得了一個非常不同的發現。他們的研究顯示,攝護腺癌腫瘤其實大量表達了PD-L1,但癌細胞並沒有將PD-L1展示在細胞表面,而是通過被稱為外泌體的分子「貨船」將PD-L1運輸了出去。
這些癌細胞中運載PD-L1的外泌體通過淋巴系統或血液流動到達淋巴結。而淋巴結正是免疫細胞被激活來保護機體的地方。在淋巴結,來自癌細胞的PD-L1蛋白髮揮著遠程抑製免疫細胞的作用,阻止這類抗癌細胞找到腫瘤。
這是非常重要的發現。外泌體PD-L1不是通過關閉腫瘤表面的免疫反應,而是在免疫細胞到達腫瘤之前就發揮了抑製作用。與表達在腫瘤細胞表面的PD-L1不同,外泌體PD-L1對現有的PD-1/PD-L1抗體具有耐藥性,但原因不明。
「我們的發現代表了對教條的突破。先前的研究認為,PD-L1作用於到達腫瘤微環境中的免疫細胞;也就是說,免疫細胞在腫瘤微環境中才能遇到具有免疫抑製作用的PD-L1。然而,我們的數據表明,對於許多免疫檢查點抑製劑耐藥性腫瘤來說,情況並非如此。這些腫瘤通過運輸外泌體PD-L1到淋巴結來逃避免疫系統的攻擊,在淋巴結中,外泌體PD-L1能夠遠程抑製免疫細胞的激活。」Blelloch教授解釋道。
Blelloch教授等之所以會想到研究外泌體,是因為他們觀察到了一些奇怪的現象:在一些耐藥性腫瘤中,儘管癌細胞PD-L1蛋白水準較低,但PD-L1 mRNA水準非常高。此外,實驗發現,PD-L1蛋白實際上在某一時刻被生產出來了,且沒有被降解。
基於這些發現,科學家們想到了外泌體,並找到了消失的PD-L1蛋白。
為了證明外泌體PD-L1能夠為癌細胞打掩護,研究人員使用了對免疫檢查點抑製劑耐葯的小鼠攝護腺癌模型。當他們將來自這些小鼠的癌細胞注射到健康小鼠中時,腫瘤瘤迅速生長。但當科學家們利用CRISPR技術刪除外泌體產生所需的2個基因時,被編輯的癌細胞無法在基因相同的健康小鼠體內形成腫瘤。雖然被編輯和未被編輯的癌細胞都能產生PD-L1,但只有無法產生外泌體的癌細胞才能夠在PD-L1被阻斷時被免疫系統識別和攻擊。
在另一項補充實驗中,健康小鼠在被移植了被CRISPR編輯過的癌細胞後,又立即被注射了攜帶PD-L1的外泌體。結果顯示,注射到小鼠體內的攜帶PD-L1的外泌體能夠抑製抗癌免疫反應,從而使缺乏外泌體的癌細胞形成腫瘤。
Blelloch教授認為,抑製外泌體釋放PD-L1將成為一種新的治療途徑,無論是單獨用藥,還是結合當前的PD-1/PD-L1抗體,都將有望克服大部分患者對現有免疫檢查點抑製劑的耐藥性。
在這項新研究中,科學家們還發現了另一個令人驚訝的結果。他們能夠利用經CRISPR編輯的缺乏外泌體的癌細胞來誘導抗腫瘤免疫反應,這種免疫反應能夠靶向通常對免疫攻擊耐葯的腫瘤。
具體來說,研究中,Blelloch博士等首先將經CRISPR編輯的無法產生外泌體的癌細胞移植到正常小鼠體內,然後等待90天。接著他們將未經編輯的癌細胞(這些癌細胞可能具有免疫逃逸能力)移植到相同的小鼠體內。結果顯示,在免疫系統暴露於經CRISPR編輯的無法產生外泌體的癌細胞之後,未經編輯的癌細胞不再被忽視,免疫系統能夠對這些先前無法被識別的癌細胞做出強有力的反應,阻止癌細胞增殖。
研究人員解釋,在暴露於不能產生外泌體PD-L1的癌細胞後,免疫系統會產生一種抗腫瘤記憶。一旦這種記憶形成,免疫系統就不再對外泌體PD-L1敏感,因此也可以靶向可產生外泌體PD-L1的癌細胞。
當被CRISPR編輯過無法產生外泌體的癌細胞和未被編輯的癌細胞同時被移植到同一隻老鼠的不同部位後,科學家們再次感到驚訝。儘管兩種癌細胞是同時注射的,但被CRISPR編輯過的癌細胞佔主導地位,它們能夠激活免疫系統發起攻擊,摧毀生長在另一邊由未經編輯的癌細胞發展而成的可能能夠抵抗免疫反應的腫瘤。
這些發現暗示了一種新的免疫療法,即,患者的癌細胞可以經過基因編輯,然後再回輸到體內,以激活免疫系統攻擊具有免疫反應耐藥性的癌症。
總結來說,作者們認為,這一發現的重要性是顯而易見的。目前臨床上還沒有有效的藥物能夠抑製外泌體PD-L1的破壞力。因此,進一步了解外泌體PD-L1的生物學特性有望帶來新的免疫療法,以攻克許多目前治療無效的侵襲性腫瘤,讓更多患者受益。
參考資料:
1.Cancer exports molecular "saboteurs" to remotely disarm immune system
2.Newdrugs that unleash the immune system on cancers may backfire, fueling tumor growth