藥品安全關係到人民群眾的健康和生命,是重大的民生問題。每年舉辦的「全國安全用藥月」活動,旨在通過活動搭建平台,傳播安全用藥科學理念和實用知識、宣傳醫藥領域最新技術成果、宣貫相關法規政策等。今年的「全國安全用藥月」,本刊特別邀約《實用臨床藥物學》一書的三位臨床和藥理學專家,就他們各自研究領域,對目前研究熱點腫瘤免疫治療明星葯抗PD-1/PD-L1 單抗、臨床各科常用的降壓消腫利尿劑及未來藥物研發方向基因組學在藥物個體化治療中的應用,做了專業的科普解讀,期望通過專家解讀,引起全社會對安全用藥的了解和關注。


輸
目前腫瘤治療藥物中最閃耀的明星無疑是免疫治療中的抗PD-1/PD-L1 單抗。由於抗PD-1 單抗Pembrolizumab 成功地使美國前總統卡特的黑色素瘤腦轉移完全緩解, 一時名聲大噪,被稱為「總統葯」。抗PD-1/PD-L1 單抗還使部分無藥可救的晚期癌症患者能獲得長達5 年甚至10 年以上的生存期,為患者的重生帶來了新的曙光,被坊間冠於「 神葯」 之稱。2013年《Science》將其評選為當年全球十大科學研究突破之首[1]。PD-1/PD-L1 單抗的發展可謂是突飛猛進、日新月異。2006 年開始做第一項臨床研究,2014 年7月正式獲批上市, 到目前為止,短短4 年時間已經有5 個抗PD-1/PD-L1 單抗、幾十個適應證獲批,上百個抗PD-1/PD-L1 單抗、上千項臨床研究在研。本文簡要介紹一下抗PD-1/PD-L1 單抗作用機制、目前進展、不良反應及應對措施等。

1
什麼是PD-1/PD-L1
PD-1( programmed death protein 1),全稱為程式性死亡受體1,是一個非常重要的免疫檢查點(Immune checkpoint),屬於B7-CD28 受體超家族成員。其最初是日本京都大學Tasuku Honjo 教授1992 年在The EMBO Journal 發表的文章首次報導,認為激活PD-1 可能會引起程式性死亡[2]。不過限於當時的認知和細胞凋亡如火如荼開展的時代背景,PD-1 的發現在很長一段時間內並沒有得到太多重視。PD-1 是一個可被誘導表達的蛋白,即T 細胞在未被激活的時候是幾乎沒有表達的,只有在T 細胞活化之後,PD-1 才會被誘導表達。除了在活化成熟的T細胞上有表達,PD-1 還在B 細胞、NK 細胞、DC 細胞及部分腫瘤細胞中有表達。1999 年,華裔教授陳列平在Nature Medcine 發表文章報導了B7 家族的第三個成員B7-H1, 即PD-1 的配體之一PD-L1(programmed deathligand 1)[3]。2001 年,美國Gordon Freeman 在Nature Immunology 又率先報導了PD-1 的另一個配體PD-L2[4]。PD-L1 和PD-L2 兩者都屬於B7 配體家族,有34% 的同源性,為什麼有抗PD-L1 單抗「神葯」,卻沒有抗PD-L2 單抗「 神葯」呢?那是因為PD-L1 和PD-L2兩者之間有很大差異,首先表達載體不一樣,PD-L1 在成熟的CD4+、CD8+T 細胞及B 細胞、樹突細胞、巨噬細胞、間充質乾細胞以及非造血細胞等多種細胞中均有表達,在多種腫瘤細胞如黑色素瘤、肺癌、尿路上皮癌、頭頸部鱗癌等高表達,而PD-L2的表達範圍較窄,主要表達於B細胞。此外,兩種配體與PD-1結合的親和力也有差異,PD-L2對PD-1 的親和力是PD-L1 的3~4 倍, 也即PD-L1/PD-1 解離率為PD-1/PD-L2 的3~4 倍。鑒於這些差異,目前針對腫瘤免疫治療信號通路的研究主要集中在PD-1/PD-L1 相互作用上。
PD-1/PD-L 通路不僅在我們所熟知的抗腫瘤方面扮演重要角色,同時在抗感染、抗自身免疫性疾病及器官移植存活等方面亦有重要意義。


2
抗PD-1/PD-L1 單抗如何抗擊腫瘤
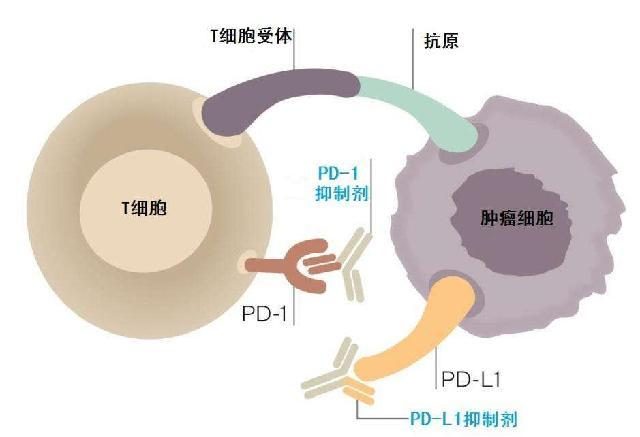
與既往的傳統治療如化療、放療及靶向治療等直接殺傷腫瘤細胞不同, 抗PD-1/PD-L1 單抗是通過作用於免疫系統間接殺傷腫瘤細胞。在人體的免疫系統中,有一種重要的免疫細胞叫作T 細胞,就像是身體的衛士,在外界有害物質入侵機體時,T 細胞通常會誘發免疫反應,從而消滅異物。但是為了避免過度活躍的免疫反應對健康組織也造成損害,免疫系統進化出一套複雜的調節機制。在T 細胞的表面上存在著兩類蛋白,一類在受到刺激後會引起免疫反應, 另一類在受到刺激後會抑製免疫反應,PD-1、PD-L1 就屬於這類負性調控分子,好比免疫的「剎車」系統。活化的T 細胞上的PD-1與抗原遞呈細胞上的PD-L1 一旦暗號對接成功,免疫細胞就認為「沒有異常」,於是便不會發動攻擊。這本是機體維持自身平衡的一種正常機制。但腫瘤細胞就像體內的叛徒,在與免疫系統的鬥爭過程中破解免疫系統的這套暗號,於是通過過度表達PD-L1來武裝自己,迷惑了T 細胞,使腫瘤微環境中PD-1/PD-L1 通路持續激活,抑製人體免疫系統反應,逃避免疫監視與攻擊,最終成功逆襲,不斷增殖發展壯大,如圖1[5]。

圖1 T 細胞PD-1 與腫瘤細胞PD-L1 結合,抑製T 細胞功能,癌細胞逃避免疫攻擊
圖片來源:Malini Guha. The new era of immune checkpoint inhibitors. Pharm.J.2014,18:1-9.
在這種情況下,全世界的科學家經過數十年艱苦卓絕的不懈奮鬥,終於找到了應對的策略,那就是將PD-1 與PD-L1 對接的通路封閉,因此針對PD-1 或PD-L1 設計特定的蛋白質抗體,即抗PD-1 或PD-L1 單抗, 使免疫系統「剎車」鬆開,這時T細胞的活性就得以恢復,可以識別出隱藏在面具下的叛徒,最終將腫瘤細胞成功圍剿,如圖2[5]。

圖2 抗PD-1/PD-L1 單抗解除PD-1/PD-L1 的結合,恢復T 細胞活性
圖片來源:Malini Guha. The new era of immune checkpoint inhibitors. Pharm.J.2014,18:1-9.


3
抗PD-1/PD-L1 單抗研究進展
抗PD-1/PD-L1 單抗從最初的雙蚌相爭,到三分天下,而後發展成四大金剛, 現在儼然已是五朵金花。目前國外已有5 種抗PD-1/PD-L1 單抗上市,包括2 種抗PD-1 抗體,即Nivolumab( 商品名Opdivo)和Pembrolizumab( 商品名Keytruda),3 種抗PD-L1 抗體, 即Atezolizumab( 商品名Tecentriq)、Avelumab( 商品名Bavencio)和Durvalumab(商品名Imfinzi),獲批的適應證涵蓋十幾個瘤種(見表1)[6]。其中處於領先地位的是Nivolumab 和Pembrolizumab。根據吳一龍教授牽頭的CheckMate 078 研究結果,我國在2018 年6 月15 日迎來了第一個抗PD-1 單抗藥物Nivolumab 的上市,國家葯監局批準的適應證為二線治療非小細胞肺癌(NSCLC)。這標誌著我國NSCLC 也邁入了免疫治療新時代。表1 FDA 批準的抗PD-1/PD-L1 單抗適應證


3.1 非小細胞肺癌(NSCLC)
肺癌發病率位居癌症首位, 是醫藥產業必爭之地, 不斷上演著一場場精彩絕倫的商業大戰。2015 年,Nivolumab的CheckMate 017 研究( 鱗癌)、CheckMate 057 研究(非鱗癌) 都獲得了陽性結果, 療效碾壓標準治療多西他賽, 將生存期延長了約3 個月, 奠定了Nivolumab 二線治療的地位。同樣在2015 年,Pembrolizumab根據KEYNOTE-001 研究的數據,被批準PD-L1 陽性晚期NSCLC 的二線治療,然而,與Nivolumab 定位策略不同的是,Pembrolizumab 將目標人群鎖定在PD - L1 陽性的患者,同時發現PD-L1 高表達人群(PDL1≥ 50% ) 療效更好。在二線全面獲得成功後,就開始進軍角逐一線。Nivolumab 為了擴大市場,採取了比較大膽的策略,入組人群是PD-L1 陽性的患者,然而讓人猝不及防的是CheckMate 026 研究結果未達到預期目標。CheckMate 026 的失敗讓BMS公司股價大跌,市值縮水200 多億。不過這也給研究者及腫瘤醫師敲了一記警鐘, 抗PD-1/PD-L1 單抗並非萬能神葯,需要篩選出能獲益的優勢人群才能確保研究的成功。BMS 後來找到了一個讓Nivolumab 在肺癌一線絕處逢生的武器:腫瘤突變負荷(Tumor mutation burden,TMB)。對CheckMate 026 研究事後分析顯示,TMB 高的患者Nivolumab 的療效較化療延長無進展生存期將近4 個月。近期公布的CheckMate 227 研究同樣證實了Nivolumab 聯合Ipilimumab 或Nivolumab 聯合化療在TMB 高的患者療效優於單用化療, 而在TMB 低的患者中, 三種方案療效並無差異。反觀Pembrolizumab 在一線治療走的更加謹慎,在篩選人群方面標準更為嚴格, 入組患者PD-L1 表達需≥ 50%, 最終KEYNOTE-024 研究取得了陽性結果。在PD-L1 高表達的患者中,Pembrolizumab 的療效明顯優於含鉑雙葯化療,2016年獲批用於PD-L1 高表達患者的一線治療,成功實現了彎道超車。為更進一步擴大適應人群,Pembrolizumab 採用了聯合治療方式,KEYNOTE-021 G 隊列,無論是PD-L1 陽性或是陰性的非鱗NSCLC 中,Pembrolizumab聯合培美曲塞/ 卡鉑方案都較單用化療顯著提高了療效,基於該研究,獲得了FDA 的快速審批,近期公布的KEYNOTE-189 研究進一步驗證了這一結果。同樣,在未經PD-L1 選擇的鱗癌中,KEYNOTE-407 研究也顯示Pembrolizumab 聯合卡鉑/紫杉醇或白蛋白紫杉醇的療效明顯優於單用化療,將生存期延長了4 個多月,這對進展非常緩慢的鱗癌來說無疑是一次重大的突破。至此Pembrolizumab 在肺癌領域已經取得了壓倒性的優勢。
Atezolizumab 作為後起之秀, 與前兩者相比療效也毫不遜色。2016 年10 月, 根據POPLAR 和OAK 研究的結果,Atezolizumab 被FDA 批準二線治療晚期NSCLC。POPLAR Ⅱ期研究顯示,Atezolizumab 對比多西他賽生存期有顯著獲益,PD-L1 表達越高的患者,生存獲益越顯著。OAK Ⅲ期研究驗證了同樣的結果。Durvalumab成為繼羅氏Atezolizumab、輝瑞/ 默克Avelumab 之後第3 個抗PD-L1 單抗藥物。2017 年ESMO 大會公布了Durvalumab 在肺癌的重磅研究PACIFIC, 接受了至少2 周期以鉑類為基礎的化放療後尚未出現疾病進展的NSCLC 患者隨機接受Durvalumab 和安慰劑,Durvalumab 顯著延長了無進展生存時間11.2 個月,以至於被稱為免疫治療的一場「海嘯」。毫無疑問,基於這個研究,Durvalumab 被FDA 批準用於經放化療治療後無進展的晚期NSCLC 的治療。


3.2 黑色素瘤
免疫檢查點抑製劑最早在黑色素瘤中研究, 也是最早在黑色素瘤中獲批適應證。早在抗PD-1/PD-L1 單抗之前, 另外一種免疫檢查點抑製劑抗細胞毒性T 淋巴細胞相關抗原4(cytotoxic Tlymphocyte associated antigen-4, CTLA-4)單抗Ipilimumab 在2011 年獲得FDA 批準,成為第一個被批準用於轉移性黑色素瘤的免疫治療藥物,從而開啟了免疫治療的全新時代。
2014 年7 月,日本正式批準Nivolumab 在日本上市,用於不可切除的黑色素瘤。Nivolumab成為第一個獲批上市的抗PD-1/PD-L1 單抗藥物。同年年底,Nivolumab 獲得FDA 批準上市,用於經Ipilimumab 或BRAF 抑製劑(BRAF 突變) 治療後進展的無法手術切除或晚期黑色素瘤患者的二線治療,此次獲批是基於CheckMate 037 研究的結果,Nivolumab 較標準化療將客觀緩解率提高了約20%。基於CheckMate 066 研究, 在初治BRAF V600 野生型患者中,Nivolumab 相比於標準治療達卡巴嗪延長了生存期, 這讓Nivolumab 成為抗PD-1/PD-L1 治療領域首個獲批用於黑色素瘤(BRAF 野生型) 一線治療的抗PD-1/PD-L1 單抗。2015 年,基於CheckMate 069 研究結果,Nivolumab 聯合Ipilimumab 被批準一線治療BRAF V600 野生型不可切除或轉移性惡性黑色素瘤。研究發現, 與Ipilimumab 單葯治療相比,Nivolumab 聯合Ipilimumab治療將BRAF 野生型黑色素瘤患者的客觀緩解率提高了將近50%, 無進展生存期延長了約4個月。2016 年,Nivolumab 聯合Ipilimumab 的適應證進一步擴大,被批準用於不可切除或轉移性惡性黑色素瘤的一線治療(無論BRAF 突變與否)。獲批是基於CheckMate 067 研究, 結果顯示,Nivolumab 聯合Ipilimumab相比於單葯 Ipilimumab, 結果依然很驚艷,而且療效與預測標誌物BRAF 突變情況無關, 與PD-L1 表達水準無關。2017年,FDA 批準Nivolumab 作為經過手術完全切除的淋巴結轉移或轉移性黑色素瘤患者的單葯輔助治療, 基於CheckMate 238臨床研究獲批,研究顯示在複發風險較高的Ⅲ / Ⅳ期黑色素瘤術後患者中,Nivolumab 輔助治療優於Ipilimumab 的標準治療。Nivolumab 相較Ipilimumab 無複發生存率更高,且副作用更少。
2014 年9 月,FDA 根據KEYNOTE-001 研究結果, 加速審批Pembrolizumab 用於不可手術或轉移性惡性黑色素瘤的二線治療。2015 年12 月, 基於KEYNOTE-006 研究結果,Pembrolizumab 的療效遠遠優於Ipilimumab, 將客觀緩解率提高了約20%,同時延長了患者生存期。因此,FDA 擴大了Pembrolizumab 的適應證, 批準其作為不可切除或轉移性黑色素瘤患者一線治療藥物( 無論BRAF 突變與否)。Nivolumab已經取得了輔助治療適應證,默沙東同樣也在這方面布局,KEYNOTE-054 研究顯示, 經手術切除的Ⅲ期黑色素瘤患者輔助Pembrolizumab 相比安慰劑組,顯著改善了患者的無複發生存期,有望獲批上市。


3.3 尿路上皮癌
尿路上皮癌是目前為止獲得抗PD-1/PD-L1 單抗適應證最多的瘤種,5 個抗PD-1/PD-L1 單抗在尿路上皮癌都有相應的適應證。
Atezolizumab 雖然在肺癌、黑色素瘤等其他領域落後於Nivolumab 和Pembrolizumab,不過在尿路上皮癌卻成為首個獲批的免疫檢查點抑製劑。2016 年5 月,基於IMVigor 210 研究的一個隊列,FDA 批準Atezolizumab作為鉑類治療失敗的轉移性尿路上皮癌二線治療。但是Atezolizumab 對比標準治療的Ⅲ期確證性研究IMvigor 211 卻遭遇滑鐵盧,研究未能到達主要終點,Atezolizumab 相比化療沒有改善患者的總生存期。2017年4 月,Atezolizumab 又憑藉IMVigor 210 研究的另外隊列,再次獲得FDA 加速批準,用於一線治療不適合接受鉑類藥物化療的晚期尿路上皮癌。
2017 年2月,基於CheckMate 275 研究,FDA 批準Nivolumab用於鉑類治療失敗局部晚期或轉移性尿路上皮癌的二線治療。研究結果顯示,總體人群的客觀緩解率達到19.6%,PD-L1 ≥ 1% 的亞組中位生存期達到11.3 個月。
2017 年5 月,Pembrolizumab同時獲FDA 批準用於晚期尿路上皮癌一線及二線治療的2個適應證。一線獲批的適應證基於KEYNOTE-052 Ⅱ 期研究, 結果顯示客觀緩解率達到29%。二線治療的獲益基於Ⅲ期KEYNOTE-045 研究, 這是首個與化療頭對頭相比生存期超過化療的免疫檢查點抑製劑,生存期延長了大約3 個月。
在同年5 月,FDA 也批準了Avelumab 和Durvalumab用於晚期尿路上皮癌二線治療,Avelumab 的批準基於JAVELIN Ib期研究的尿路上皮癌隊列,Durvalumab 的批準基於1108 I/II期研究的尿路上皮癌隊列。


3.4 微衛星不穩定的實體瘤
2017 年5 月,FDA 加速批準了Pembrolizumab 用於標準治療後進展的高微衛星不穩定(microsatellite instabilityhigh,MSI-H) 或錯配修復缺陷(mismatch repair deficient,dMMR)的成人和兒童晚期或轉移性實體腫瘤患者。這是FDA 首次基於分子標誌物而非既往依照腫瘤來源的獲批,成為腫瘤藥物治療史上又一個重要的裡程碑。該適應證的批準基於5 個臨床研究,共納入15 個瘤種有MSI-H和dMMR 的149 名患者, 其中90 名為結直腸癌。總體人群的客觀緩解率達39.6%。結直腸癌患者客觀緩解率為36%。


4
常用標誌物
抗PD-1/PD-L1 單抗有「神葯」 之稱, 囊括了幾十種適應證,是否適合所有的患者呢?其實從NSCLC 的二線治療看,抗PD-1/PD-L1 單抗的治療緩解率大約在15%~30%,獲益人群是比較少的,加之免疫治療費用昂貴,因此有必要採用標誌物篩選出真正合適免疫治療的患者。目前研究比較多的三大標誌物,分別是PD-L1、TMB、微衛星不穩定(microsatellite instability,MSI)和dMMR。
4.1 PD-L1
目前研究最早最多的是PD-L1。腫瘤細胞抑製T 細胞功能的機制之一就是高表達PD-L1,因此理論上認為,PD-L1 表達越高, 療效越好。臨床上大多數研究也證實確實如此。然而,PD-1 表達陰性的一部分患者也能從抗PD-1/PD-L1 單抗中獲益, 而且像Nivolumab 的CheckMate 017、CheckMate 026 及CheckMate 227 等研究顯示,Nivolumab 與PD-L1 表達並無相關性。此外,還有很多因素影響PD-L1,如腫瘤細胞PD-L1 的表達在疾病的不同階段發生動態變化,同一個患者原發灶與轉移灶PD-L1 表達不同,各家公司採用的檢測抗體不一致,PD-L1 陽性界值也不一樣等,這些問題尚待解決。因此,PD-L1是目前最常用的一個標誌物,但不是最理想的標誌物。


4.2 TMB
TMB 是指腫瘤組織每兆鹼基中突變的數目,簡單地說,TMB越高, 腫瘤的個性特徵就越明顯,越不同於正常細胞,越容易被免疫細胞識別出來,免疫反應越強,療效就越好。目前研究顯示,無論是被TMB 拯救於水火的Nivolumab,還是Pembrolizumab和Atezolizumab, 都顯示TMB與療效成正相關。但是TMB 同樣也存在很多問題,除了與PD-L1一樣的檢測結果有時間、空間異質性,TMB 的陽性界值不一致。此外,TMB 檢測價格昂貴,時間長,解讀數據複雜,目前TMB主要用於臨床研究。
4.3 MSI 或dMMR
人體細胞中存在一類能修復DNA 鹼基錯配的安全保障體系,稱之為DNA 錯配修復(mismatch repair,MMR) 系統。錯配修復缺陷(dMMR),顧名思義,就是MMR 修復機制出現故障。MSI 由於MMR 功能缺陷,從而導致微衛星重複序列長度的改變。dMMR的腫瘤細胞較MMR 正常腫瘤細胞更容易累積突變,產生新抗原,容易被免疫系統識別,理論上免疫治療療效更好。Pembrolizumab及Nivolumab 的數個研究都顯示,抗PD-1/PD-L1 單抗對MSI-H或dMMR 的結直腸癌或其他實體瘤種療效顯著,而對MSI-L 患者基本無效。目前dMMR 標誌物研究還比較少,主要集中在結直腸癌,還需在其他瘤種以及其他抗PD-1/PD-L1單抗中進一步研究。
除了上述3 種標誌物以外,目前還有一些標誌物如POLE 基因突變、新抗原水準、腫瘤浸潤的淋巴細胞、EGFR 突變水準等處於研究中。但是令人遺憾的是,沒有一個標誌物可以明確地告訴患者, 使用抗PD-1/PD-L1 單抗是否有效。不過可以將多個指標聯合分析,一方面可以更進一步精選優勢人群,提高命中率;另一方面也可以避免僅檢測一個指標而錯失使用免疫檢查點抑製劑治療的機會。


5
不良反應及處理
與其他抗腫瘤藥物一樣,抗PD-1/PD-L1 單抗使用過程中也會伴隨發生與其作用機制相關的不良反應,稱為免疫相關不良反應(irAE)。與化療所致的不良事件相比,irAE 可能具有遲發、持續時間長和累及器官多的特點。irAE 主要分為常見的免疫相關皮膚毒性、內分泌疾病、肝臟毒性、胃腸道毒性、肺炎以及罕見的免疫相關毒性如神經系統毒性、心臟毒性、風濕免疫毒性、腎毒性、眼毒性等。irAE 發生時間尚無明顯規律可循,irAE 可在給葯後的幾天至幾個月內發生,皮膚反應為最先發生的irAE。irAE 的嚴重程度可以從無癥狀到嚴重甚至危及生命。聯合治療時,可能會增加irAE 的嚴重程度。
大部分的irAE, 如果早期發現和早期治療,都可以得到有效控制,因此需要對患者加強教育及定期監測以發現任何可能發生的irAE 並及時給以相應的處理。irAE 的處理可參照美國臨床腫瘤學會(ASCO)聯合美國國立綜合癌症網路(NCCN)發布的免疫治療相關不良反應管理指南[7,8]。對於1 級毒性(除一些神經、血液學和心臟毒性以外),在密切監視下繼續接受免疫治療;對於大多數2 級毒性, 可能需要暫停免疫治療,當不良事件恢復至1 級或1 級以下時考慮繼續治療, 可能需要使用皮質類固醇;對於3 級毒性,停止免疫治療,並開始使用大劑量的皮質類固醇。如果在接受大劑量的皮質類固醇治療48~72 小時後癥狀仍沒有緩解,那麼可能需要使用免疫抑製劑。不良事件恢復至1級或1 級以下時,可再次使用免疫檢查點抑製劑,但如果再次出現相應的毒性,需永久終止免疫治療;對於4 級毒性,除了使用皮質類固醇治療或免疫製劑,可能需要永久中止使用免疫檢查點抑製劑治療。
總之, 抗PD-1/PD-L1 單抗發展如火如荼、方興未艾,一路披荊斬棘,製藥公司、醫務人員甚至患者都為之瘋狂。確確實實給很多瘤種的治療帶來了質的飛躍,為患者帶來重生的希望。但同時也要注意抗PD-1/PD-L1單抗並非萬能神葯,獲益人群是有限的,而且有潛在的危害,嚴重的甚至危及生命,臨床應用還需慎重選擇。
作者簡介
趙新漢,醫學博士,西安交通大學第一附屬醫院腫瘤學二級教授,一級主任醫師,博士研究生導師,博士後導師,西安交通大學第一附屬醫院長安區醫院院長。近年來重點從事腫瘤相關基因的基礎與臨床研究,主持國家自然科學基金項目5項,主持陝西省「13115」科技創新工程重大科技專項項目1 項,教育部博士點基金1 項,吳階平醫學基金會臨床科研專項資助基金2 項。發表科研論文100 余篇,其中SCI收錄50 余篇。
本文參考文獻請掃描二維碼查閱
來源/趙新漢.腫瘤免疫治療明星葯──抗PD-1/PD-L1 單克隆抗體[J].中國食品藥品監管.2018.10(177):35-41