如何改變免疫微環境使之響應免疫治療,是擴展免疫治療應用範圍、提高治療效率的重要研究方向。

自2014年9月FDA加速批準第一個PD-1免疫檢查點抑製劑用於二線治療黑色素瘤以來,至今已有5個PD-1/PD-L1抑製劑(帕博利珠單抗、納武利尤單抗、阿特珠單抗、Avelumab和Durvlumab),共獲批用於非小細胞肺癌、尿路上皮癌等12種實體瘤和所有微衛星高不穩定性(MSI-H)實體瘤的二/三線甚至一線治療。免疫治療已成為繼靶向治療後,腫瘤治療領域的重要進展。特別是對於沒有靶向驅動基因變異及治療靶點的患者,免疫治療的出現給他們帶來了新的希望。同時,臨床研究表明,腫瘤患者一旦響應免疫治療,往往能帶來長期的獲益,甚至是疾病的完全緩解。
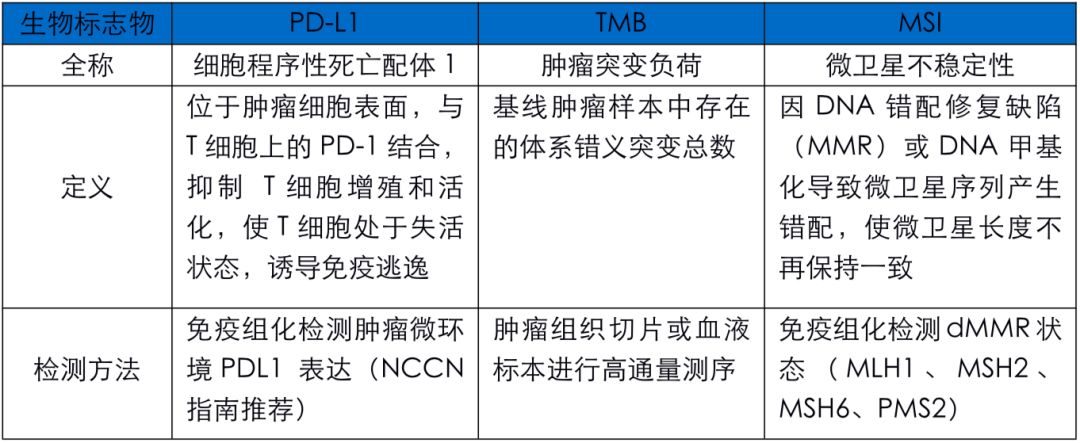
然而,目前仍然沒有一種非常有效的單一針對PD-1/PD-L1抑製劑療效預測的分子標誌物。 FDA批準用於指導免疫治療患者篩查的biomarker中, PD-L1表達陽性患者的免疫治療有效率仍然很低(除淋巴瘤外,客觀緩解率ORR介於10%~40%)。
對於MSI-H實體瘤而言,PD-1/PD-L1抑製劑治療的有效率達到53%,但由於除子宮內膜癌、胃腺癌和結直腸癌外,MSI-H實體瘤尤其是晚期實體瘤,佔所有實體瘤中比例較低,獲益的患者有限。


?不同早期和晚期實體瘤的MSI-H患者比例
同時,研究表明腫瘤突變負荷(TMB)是一種預測PD-1/PD-L1抑製劑治療的重要標誌物,然而高TMB(TMB-H)患者的客觀緩解率也僅有約30%。TMB聯合PD-L1預測PD-1/PD-L1抑製劑效果也並不理想(ORR介於20%-75%)。


?TMB-H和PD-L1 High非小細胞肺癌的PD-1抑製劑有效率
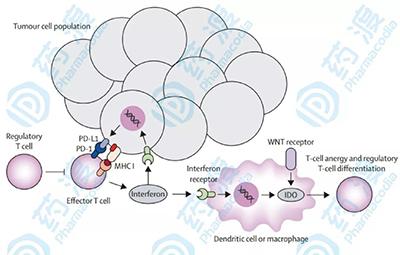
PD-L1蛋白表達反映的是腫瘤組織中潛在的PD-1/PD-L1藥物作用靶點,而MSI-H和TMB-H一定程度上能反映患者腫瘤新抗原的數量。為什麼PD-L1表達陽性和TMB-H的患者響應PD-1/PD-L1抑製劑仍不理想呢?研究發現其中部分原因可能和腫瘤的免疫微環境有關,當中最重要的是腫瘤浸潤淋巴細胞(TILs)的狀態相關,只有在有浸潤淋巴細胞存在的情況下,新抗原才能體現出免疫原性。
「冷腫瘤」、「熱腫瘤」與腫瘤的免疫分型有研究根據TILs的存在與否,將腫瘤分為所謂的「冷腫瘤」和「熱腫瘤」,簡而言之,熱腫瘤是有浸潤淋巴細胞的腫瘤,而冷腫瘤則相反。「熱」和「冷」反映的是腫瘤是否有免疫原性。
同時通過PD-L1表達和TILs這兩個標誌物,將實體瘤分為4種類型(腫瘤免疫浸潤分型,TMIT),分別為TMIT I~IV。其中以CD8A mRNA表達和CYT1(GZMA、PRF1mRNA表達)反映TILs。


?實體瘤的免疫分型
顯而易見,冷腫瘤的PD-1/PD-L1抑製劑的有效率可能較低(TMIT II和IV型),而熱腫瘤中PD-L1高表達的腫瘤(TMIT I型)更有可能響應PD-1/PD-L1治療,同時TMIT I型的患者可能有更多的腫瘤新抗原。
對14種實體瘤的分析表明,同一種腫瘤的4種分型的比例不相同,不同腫瘤的4種分型的比例也不一樣,如對於皮膚黑色素瘤(SKCM),I~IV型的比例分別為37%、32%、3%和28%。


?不同腫瘤的4種TMIT分型的比例
如果以腫瘤新抗原來對4種免疫分型的的PD-1/PD-L1抑製劑響應情況進行分類,會發現14種腫瘤中有8種(肺鱗癌、肺腺癌、膀胱癌、乳腺癌、宮頸癌、結直腸癌、胃癌和皮膚黑色素瘤)的I型與新抗原增加相關,因此以上類型的腫瘤的TMIT I型更可能從抗PD-1/PD-L1治療中獲益,並從側面證實了TMIT分型的有效性。
通過TILs和PD-L1進行分型的思路也經過了伊匹單抗(anti-CTLA4)治療黑色素瘤的驗證,CD8+ IHC陽性和PD-L1陽性的患者響應治療的情況更好。
「冷」、「熱」腫瘤的轉換:腫瘤免疫微環境的動態變化
然而,TMIT I型不同患者中,TILs的細胞類型和功能狀態並不相同。同一患者不同時間TILs也並不是一成不變的,TILs的mRNA和蛋白表達會受疾病治療等的影響,腫瘤免疫微環境的異質性影響了不同患者對免疫治療的響應。
研究分析TILs不同類型細胞對免疫治療的影響,CD3+和CD8+ TILs與非小細胞肺癌、黑色素瘤等實體瘤更好的臨床獲益相關,然而只有CD8是一個獨立的預後因素。而FOXP3+調節性T細胞等與免疫獲益負相關。臨床研究證實PD-L1表達陽性的TILs響應阿特珠單抗治療。
有研究發現,T細胞的受體中免疫檢查點抑製、T細胞primed、炎症反應等相關基因的表達,T細胞受體克隆性等也與免疫獲益相關。
同時,TILs細胞類型、T細胞受體的克隆變化、腫瘤放化療後的新抗原變化等都能反映免疫微環境動態變化的一部分,這些都能反映腫瘤對免疫治療的響應。


?免疫治療非響應者可轉化為響應者
免疫微環境的變化,可能會使原本並不響應免疫治療的患者,變為響應治療。而如何篩選這類患者,或者如何改變免疫微環境使之響應免疫治療,是擴展免疫治療應用範圍、並提高免疫治療有效率的免疫治療研究的重要方向。
多個研究表明放化療後,腫瘤會產生更多的突變以及腫瘤新抗原;經伊匹單抗治療耐葯後,TILs增多(CD8、CD4表達上升)的腫瘤更容易響應抗PD-1/PD-L1治療。
該發現可以解釋此前免疫治療在多種實體瘤中的二線/三線治療中的效果較好,即多線治療後,可能會有部分「冷」腫瘤轉化為了「熱」腫瘤。然而,免疫治療能否替代放化療等的一線治療呢?免疫治療聯合其他療法成為腫瘤一線治療研究的重要手段。
目前免疫治療聯合化療和多個免疫抑製劑聯合治療(如納武利尤單抗聯合伊匹單抗)正在進行多個臨床試驗。如Keynote189試驗已證實了帕博利珠單抗聯合培美曲塞+卡鉑/順鉑,相比安慰劑+培美曲塞和卡鉑/順鉑,在未治轉移性非鱗非小細胞肺癌中,無論是PFS還是OS,均有極大的提升(12個月OS率69.2% vs 49.4%;中位PFS8.8個月 vs 4.9個月)。


?

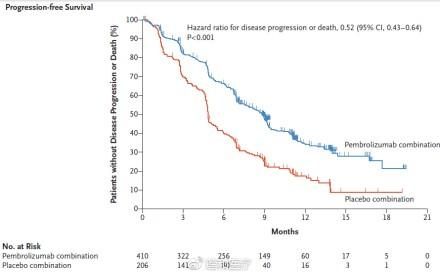
?帕博利珠單抗聯合化療的OS和PFS好於化療
同時Keynote189的結果還表明,PD-L1表達<1%的分組,免疫聯合化療的OS和PFS也好於化療,雖然PD-L1強陽性的患者獲益最高。值得注意的是,另一個IMpower150試驗中,基於PD-L1、CXCL9和IFNγ等免疫相關基因表達的分型,對阿特珠單抗治療的預測效果最好,這顯示免疫微環境的相關基因同樣可以指導免疫聯合治療。
基於蛋白表達(免疫組化等檢測)、mRNA表達(RNA-seq等檢測)等多組學的免疫微環境相關的分子標誌物已經在進行研究,如基於CD8A mRNA表達或CD8免疫組化的TILs水準聯合PD-L1蛋白表達水準可更好地篩選響應免疫治療的患者。
IFNγ等炎症反應相關基因、PD-1、PD-L1、PD-L2等免疫檢查點相關基因、GZMB等T細胞primed相關基因的表達也開始在多個臨床研究中,預測抗PD-1/PD-L1治療的有效性。
由於免疫微環境的動態變化,如果能在治療過程中,連續監測免疫微環境相關的分子標誌物,可能對於免疫治療耐葯以及假性進展等有指導作用。如在阿特珠單抗的一個I期臨床試驗中,在血漿中發現了IL-18、ITAC和CD8+HLA-DR+Ki67+ T細胞的上升。另外,血漿CD8+PD-1+ T細胞表達也是一個潛在的非小細胞肺癌抗PD-1治療的分子標誌物。
目前基本所有的免疫治療分子標誌物都是在治療前進行療效預測,如果能像靶向用藥監測一樣,在免疫抑製劑治療過程中進行無創檢測和監控,其前景將會非常廣闊。
?
?- 參考文獻
[1].George Cyriac, Leena Gandhi. Emerging biomarkers for immune checkpoint inhibition in lung cancer. Semin Cancer Biol. 2018 May 19. pii: S1044-579X(17)30250-X.
[2].L. Gandhi, et al. Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer. N Engl J Med. 2018 May 31;378(22):2078-2092.
[3].W. Joost Lesterhuis, et al. Dynamic versus static biomarkers in cancer immune checkpoint blockade: unravelling complexity. Nat Rev Drug Discov. 2017 Apr;16(4):264-272
[4].Dung T. Le, et al. Mismatch-repair deficiency predicts response of solid tumors to PD-1 blockade. Science. 2017 Jul 28; 357(6349): 409–413.
[5].Carbone DP, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med. 2017 Jun 22;376(25):2415-2426.
[6].Yu-Pei Chen, et al. Genomic Analysis of Tumor Microenvironment Immune Types across 14 Solid Cancer Types: Immunotherapeutic Implications. Theranostics. 2017; 7(14): 3585–3594.
[7].Galon J, et al. Towards the introduction of the "Immunoscore" in the classification of malignant tumours. J Pathol. 2014 Jan;232(2):199-209.
[8].Paul C. Tumeh, PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 2014 Nov 27;515(7528):568-71.
[9].Kathleen M. Mahoney, Combination cancer immunotherapy and new immunomodulatory targets. Nat Rev Drug Discov. 2015 Aug;14(8):561-84.
[10].Pei-Ling Chen, Analysis of Immune Signatures in Longitudinal Tumor Samples Yields Insight into Biomarkers of Response and Mechanisms of Resistance to Immune Checkpoint Blockade. Cancer Discov. 2016 Aug;6(8):827-37.