我國騰盛博藥公司(Brii Biosciences)旨在實現功能性治愈HBV的在研新藥BRII-179 (VBI-2601) 的2a/2b期臨床試驗首例受試者完成給藥!該候選藥物目前正由騰盛博藥和VBI Vaccines公司聯合研發中。

B肝在研新藥BRII-179,2a/2b期,首例受試者完成給藥
一、1期積極進展
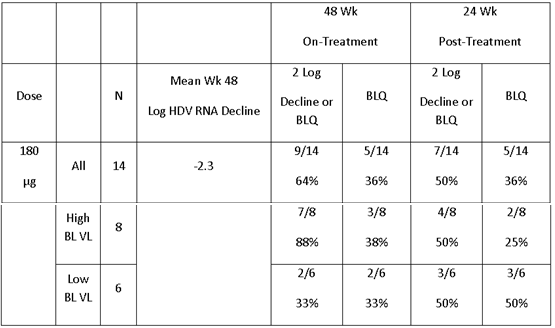
值得一提的是,2021年歐肝會上已經公布了BRII-179 (VBI-2601)已完成的1b/2a期積極試驗數據!這是一款正在臨床研究階段的新型重組蛋白免疫治療藥物。1b/2a期主要是單用BRII-179 (VBI-2601) 或聯合干擾素-α (IFN-α) 來評價藥物安全性、抗病毒活性以及免疫原性。研究結果表明,使用這種新型免疫藥物可誘導B細胞和T細胞反應,未見任何安全性信號。
二、科學家點評2期首例患者給藥
來自騰盛博藥的首席醫療官,嚴立醫學博士點評BRII-179 (VBI-2601)剛剛完成的 2a/2b期首例受試者給藥:BRII-179有可能打破慢性B肝患者的免疫耐受狀態,恢復或增強對B肝表面抗原的適應性T細胞和抗體反應。這將建立對HBV的持久免疫反應,並為實現功能性治愈慢性HBV感染創造可能。
目前,慢性B肝患者的常規療法只能獲得個位數的功能性治愈率。我們期待與中國的研究人員合作,以確定BRII-179在恢復該患者群體中HBV特異性適應性免疫功能方面的安全性和有效性,這可能轉化為顯著更高的功能治愈率。
三、成分構像和作用機理
BRII-179 (VBI-2601) 是一種基於蛋白質的新型重組HBV免疫治療候選藥物,可表達 Pre-S1、Pre-S2 和 S HBV 表面抗原,旨在誘導增強的B細胞和T細胞免疫反應。BRII-179 (VBI-2601) 的成分是建立在VBI疫苗公司預防性B肝疫苗的3抗原構像基礎上,該預防性B肝疫苗名為PreHevbrio™ 已在美國批準上市。
來自:騰盛博藥慢B肝新藥管道,紅色備注為BRII-179

四、2期試驗設計
這項剛剛啟動的2期臨床試驗是一項隨機、雙盲、安慰劑對照、平行組研究,旨在評價將BRII-179 (VBI-2601) 添加到已使用聚乙二醇化干擾素-α(PEG-IFN-α)和核苷(酸)類逆轉錄酶抑製劑(Nrtl)治療的非肝硬化慢性HBV患者中的安全性和有效性。參與該研究的患者符合預先確定的標準,即對正在接受PEG-IFN-α和Nrtl治療產生部分反應。一個獨立的數據和安全監察委員會將審查本研究患者的安全性和有效性試驗數據。
2a期:該研究的2a期部分將確定BRII-179 (VBI-2601)治療和聯合PEG-IFN-α + Nrtl治療在約120名受試者中的安全性和療效。2a期的主要終點是治療完成時,B肝表面抗原(HBsAg)清除的受試者百分比。
2b期:在2b期,該研究將擴大至480名受試者,以評價接受BRII-179(VBI-2601)聯合PEG-IFN-α + NrtI治療之後,實現功能性治愈的受試者比例。2b期的主要終點是實現持續B肝表面抗原清除和HBVDNA清除的受試者百分比。
小番健康結語:Brii -179 (VBI-2601)是一款在研治療性B肝疫苗,最近,該免疫候選藥物2a/2b期首例受試者已完成給藥。在我國進行的這兩部分研究,將會調查這款在研新型免疫治療疫苗BRII-179 (VBI-2601)在600名慢性乙型肝炎患者中的有效性和安全性(600名分別指2a期的120名+2b期的480名)。返回搜狐,查看更多
責任編輯: