2022年歐肝會上(EASL2022),研究人員也帶來了丁肝創新藥 Bulevirtide (BLV) 的最新臨床開發數據,並以題為:以2毫克或10毫克劑量水準的 Bulevirtide 單藥治療慢性丁肝的兩項2期和一項3期臨床試驗的24周數據的綜合療效分析,發布在本屆年會上。

丁肝新藥Bulevirtide,綜合療效新數據,在2022年歐肝會發布
Bulevirtide(BLV)是一種新型一流病毒進入抑製劑,已於2020年7月,在歐盟有條件批準用於治療慢性HDV感染(CHD)。此前,在2個2期臨床試驗和1個3期臨床試驗中(MYR202研究、MYR203研究和MYR301研究),單獨使用 Bulevirtide 治療慢性丁肝受試者時,已經表現出明顯的病毒和生化反應(HDVRNA水準和ALT下降)。
在本研究中,研究人員對以上3個臨床試驗的24周數據,進行了綜合療效分析。具體試驗方法如下:
該匯總分析,共納入 281 名無肝硬化或代償期肝硬化的慢性丁肝受試者,其中 92名和 95名CHD受試者接受每日一次皮下注射 2毫克或10毫克劑量的 Bulevirtide。相比之下,有 79名CHD受試者在分析期間,未接受有效抗HDV治療(對照組),15名受試者接受聚乙二醇干擾素α (Peg-IFNα)治療,目前的護理標準(SOC)未被批準用於CHD。
在第24周時,評估的主要療效終點是HDVRNA檢測不到或從基線降低 ≥2 log10 IU/ml 和 ALT 正常化的聯合反應;其他終點包括病毒應答(HDVRNA檢測不到或下降≥ 2 log10 IU/ml)、ALT正常化和 HDVRNA水準的變化。
在基線時,所有組的人口統計數據都很平衡。使用2毫克 Bulevirtide 劑量組的特徵包括:平均(SD)年齡42歲(9.0),男性佔60.9%,白人佔83.7%,患有代償性肝硬化為44.6%,患有HDV基因型 1 為 96.7%,使用核苷(酸)類似物治療為 64.1%;平均(SD)HDVRNA 為 5.2 (1.33) log10 IU/mL,平均(SD)ALT 為 107 (70.7) U/L。
bulevirtide綜合療效新數據,來自2022年歐肝會

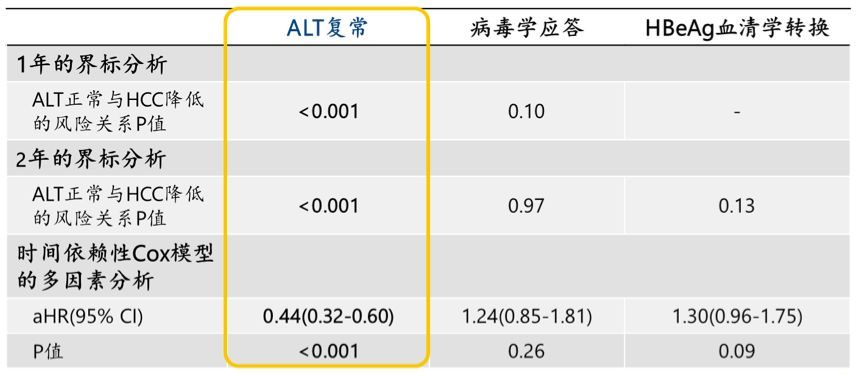
結果表明,在第24周時,2毫克與10毫克 Bulevirtide 組受試者的聯合反應分別為 31.5% 和 32.6%。雖然,2毫克 Bulevirtide 組的病毒應答率在數值上低於 10毫克 Bulevirtide 組(53.3% 和 71.6%),但 2毫克 Bulevirtide 組要比10毫克組的 ALT 正常化率在數值上更高(分別為 51.1% 和 42.1%)。在所有療效終點,與對照組或 SOC組相比,Bulevirtide組的反應率更高。
綜上所述,研究人員給出結論是:在對281名丁肝受試者的24周數據綜合療效分析中,2毫克與10毫克Bulevirtide組的綜合反應率相當;Bulevirtide治療明顯優於對照組或SOC組。這些結果為每日一次使用 2毫克 Bulevirtide 治療代償性CHD提供了額外的支持。
來自吉利德科學 HBV/HDV 新藥研發管道

小番健康結語:Bulevirtide是吉利德科學管道中針對丁肝的一種進入抑製劑,已在歐洲上市,將盡快將其推向美國本土上市用於CHD治療。本研究是一個綜合了MYR202、MYR203和MYR301研究的24周數據對劑量為 2毫克或10毫克下的Bulevirtide療效進行綜合分析,其中,接受2毫克Bulevirtide有92名CHD受試者,接受10毫克Bulevirtide有95名CHD受試者,他們均為每日一次給藥,採用皮下注射(S.C);
相比對照組和SOC組,使用以上兩個Bulevirtide劑量組,對慢性丁肝受試者進行單藥療法後綜合療效更優。返回搜狐,查看更多
責任編輯: