在2018年6月15日,我國國家食品藥品監督管理局(CFDA)正式批準百時美施貴寶PD-1單抗藥物Opdivo的上市申請。由此Opdivo/歐狄沃(納武利尤單抗注射液,Nivolumab injection)成為個在中國上市的PD-1藥物,預示著我國肺癌治療水準正式進入肺癌免疫腫瘤治療的時代,掀開我國腫瘤治療的新篇章。
同日,美國製藥巨頭百時美施貴寶(BMS)也正式公布,納武利尤單抗注射液(Nivolumab injection)作為在中國優先獲批上市的免疫腫瘤(I-O)治療藥物,已獲CFDA批準用於治療二線非小細胞肺癌。
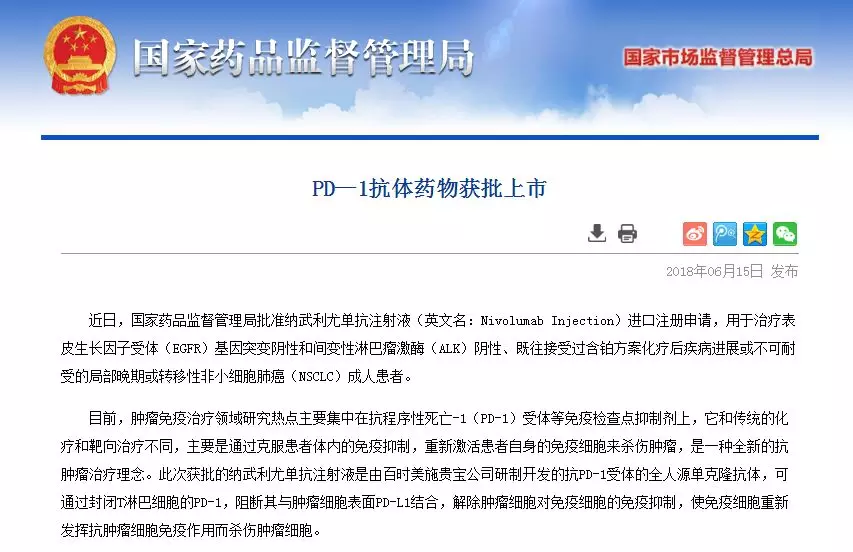
CFDA批準納武利尤單抗注射液用於治療表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、既往接受過含鉑方案化療後疾病進展或不可耐受的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者。
關於Opdivo/歐狄沃在中國購買
目前,Opdivo/歐狄沃(納武利尤單抗注射液)在中國的具體售價尚未確定,我們能了解到Opdivo將會在8月底上市,但在上市開售之後並不會馬上進入醫保目錄。
關於Opdivo/歐狄沃(納武利尤單抗注射液,Nivolumab injection)
Opdivo是世界上獲得批準的PD-1免疫檢查點抑製劑,最早是在日本獲批上市,目前Opdivo已經在美國、歐盟以及日本等60多個國家與地區獲得批準。
Opdivo獲得FDA批準的適應症:
一、黑色素瘤,FDA批準日期2014年12月22日
二、NSCLC(非小細胞肺癌),FDA批準日期2015年3月4日
三、腎細胞癌,FDA批準日期2015年11月13日
四、cHL(難治性經典霍奇金淋巴瘤), FDA批準日期2016年5月17日
五、頭頸部鱗癌,FDA批準日期2016年11月10日
六、尿路上皮癌,FDA批準日期2017年2月2日
七、結直腸癌,FDA批準日期2017年7月31日
八、肝細胞癌,FDA批準日期2017年9月22日
迄今為止,Opdivo已經有8大腫瘤適應症被FDA批準,但目前由我國國家食品藥品監督管理局(CFDA)批準的適應症只有NSCLC(非小細胞肺癌)。

關於免疫腫瘤(I-O)治療
免疫腫瘤學(immuno-oncology,I-O)志在利用人體自身免疫系統來抗擊腫瘤。也就是說,免疫腫瘤治療與傳統的化療和靶向治療都不一樣,不會直接攻擊癌細胞,而是通過克服患者體內的免疫抑製,重新激活患者自身的免疫細胞來殺傷腫瘤,是一種全新的抗腫瘤治療理念。
目前在全世界範圍內,腫瘤免疫治療領域研究熱點主要集中在抗程式性死亡-1(PD-1)受體等免疫檢查點抑製劑上,具有代表性的就是PD-1/PD-L1抑製劑、CTLA-4抑製劑。
歐狄沃(納武利尤單抗注射液)是由百時美施貴寶公司研製開發的抗PD-1受體的全人源單克隆體受體,可通過封閉T淋巴細胞的PD-1,阻斷其與腫瘤細胞表面PD-L1結合,接觸腫瘤細胞對免疫細胞的免疫抑製,使免疫細胞重新發揮抗腫瘤細胞免疫作用而殺傷腫瘤細胞。
納武利尤單抗是一種人類免疫球蛋白G4 (IgG4) 單克隆抗體(HuMAb),可與PD-1受體結合,阻斷其與PD-L1和PD-L2之間的相互作用,阻斷PD-1通路介導的免疫抑製反應,包括抗腫瘤免疫反應。在同源小鼠腫瘤模型中,阻斷PD-1 活性可抑製腫瘤生長。
關於肺癌
根據世界衛生組織(WHO)的報告,目前全世界有超過170萬的人因為肺癌失去生命。而NSCLC(非小細胞肺癌)是肺癌中比較常見的一個分型,約佔所有肺癌患者總數的85%。其他肺癌分型如鱗狀細胞癌約佔25%-30%,非鱗狀NSCLC約佔50%-65%。肺癌的生存率取決於診斷時癌症的分期和類型。對於診斷為轉移性肺癌的患者,5年生存率低於5%。
而在中國,肺癌每年的新發病例達78.1萬例,相當於平均每10分鐘就有15人罹患肺癌。讓人可怕的是,肺癌每年的發現病例還在逐漸上升,預測到2020年,每年新發病例和死亡病例將分別超過80萬和70萬。
基於目前肺癌的治療手段十分有限,獲得長期生存才是肺癌患者迫切的期望。而Opdivo/歐狄沃的獲批上市,無疑是為肺癌患者提供了新的治療方向,新機遇。
本文為「康德樂大藥房」原創,未經授權不得轉載