宋天強教授點評


宋天強教授
天津醫科大學腫瘤醫院
肝膽腫瘤科
腫瘤的大小、數目和大血管侵犯一直是評價腫瘤分期的主要指標,而精確地進行腫瘤分期是為了更好地選擇治療手段和評估預後。但是臨床中我們經常會發現,處於同一個期別的腫瘤即使治療手段相同,腫瘤的預後仍然千差萬別。究其原因,腫瘤的生物學行為應該是腫瘤分期的重要依據。
在大血管侵犯前的微血管侵犯(MVI)越來越得到重視,越來越多的研究表明,出現MVI的肝癌需要更大的切除範圍和更寬的消融邊緣,考慮肝移植候選時應更加慎重。MVI作為一個病理概念,如何在術前對其精確預測更具臨床指導意義。影像學檢查的軸位顯像以及血清和組織的標誌物檢測為術前預測MVI帶來了曙光。
通過術前的MVI精確預測,臨床能選擇更合理的治療方案,包括射頻消融或肝切除、解剖性肝切除或局部切除、肝切除或肝移植,甚至可以拓展到新輔助和輔助治療的取捨。此外,雖然傳統意義上對大血管侵犯靶向治療是首選,但是對於MVI,靶向治療也應該作為重要的系統治療手段,這樣才能真正做到給患者進行基於腫瘤生物學行為的個體化治療。
正文開始前,小編先邀您回答以下兩個小問題:
正文
儘管手術和消融是治癒肝細胞癌(HCC)的唯一手段,然而,超過一半R0切除的患者可能會經歷複發。術後2年內的早期複發與存在殘留的微轉移灶有關;而>2年的晚期複發則與肝組織長期受損新發異時性癌灶有關。微血管侵犯(Microvascular invasion, MVI)定義為在肝臟血管記憶體在轉移性的HCC微栓子,是HCC早期複發和患者存活的關鍵決定性因素。
MVI的發病機制
MVI一個簡單且被廣泛接受的定義是腫瘤細胞存在於內皮細胞襯覆的血管腔內,且僅在顯微鏡下可見。門靜脈和肝靜脈均可出現MVI,前者是肝內轉移的潛在來源,後者是遠端轉移擴散的來源,包括肝移植後的複發。肝內和遠端轉移性疾病是MVI的副產物,上皮細胞-間充質細胞轉化(EMT)轉錄程序的激活是HCC中MVI發展的重要致病步驟(見圖1)。

 播放GIF
播放GIF
圖1. 肝癌的發生、EMT和MVI
註:EMT:上皮細胞-間充質細胞轉化;EPCAM:上皮細胞黏附分子;ZEB:E-盒結合鋅指蛋白。
MVI的風險分級與臨床預後
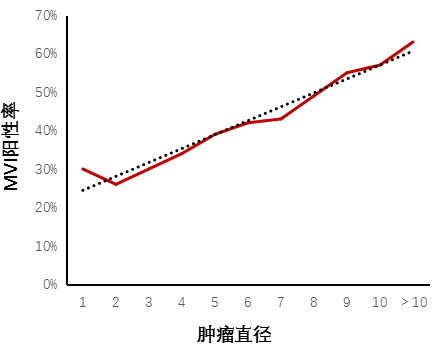
MVI經常出現在HCC中,且與不良生物標誌物高度相關,包括高級別、大尺寸腫瘤和血清AFP(甲胎蛋白)/DCP(脫γ羧基凝血酶原)升高。MVI實際上可能比傳統分級系統能更好地預測HCC的複發和患者生存。
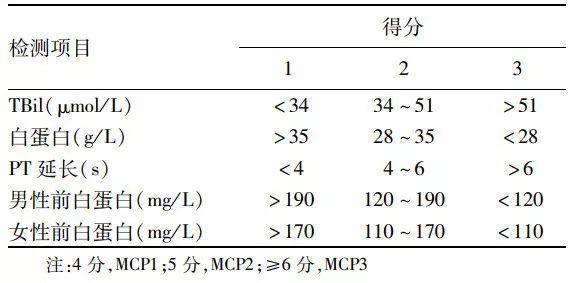
多項研究分析了MVI分級與預後的關係,MVI分級越高,總生存(OS)率和無複發生存(RFS)率越低(見圖2)2,影響MVI分級的因素包括栓子中惡性細胞的數量、是否存在血管壁侵犯以及與原發病灶的距離(見表1)。表1. MVI的分級與臨床預後


註:MVI:微血管侵犯;HCC:肝細胞癌;DCP:脫γ羧基凝血酶原;AFP:甲胎蛋白;DSS:疾病特異性存活率;RFS:無進展生存;OS:總生存;TNM:腫瘤淋巴結轉移;CUPI:香港中文大學預後指數;JIS:日本綜合分期評分。


圖2. MVI分級與總生存(OS)率及無複發生存(RFS)率
註:M0 = 無MVI;M1 = 非浸潤型,血管數<5;M2 = 浸潤型,血管數<5;或非浸潤型,血管數>5;M3 = 浸潤型,血管數>5。
MVI的臨床價值
MVI對肝切除術切緣的指導意義研究表明,對於MVI陽性,直徑約2~3 cm小病灶的HCC,解剖性切除術較非解剖性切除術更易獲得較大的手術切緣。因此,基於MVI狀態、腫瘤大小和生存率之間的關係,未來某些情況下,術前MVI狀態可能有助於指導手術治療。
消融治療對MVI陽性HCC患者存在局限性
Ueno等人的研究中,對經手術切除或經皮射頻消融(PRFA)治療直徑<5 cm的HCC患者,進行了預後影響因素的亞組分析。雖然採用兩種治療方法的所有患者在生存獲益上未見差異,但對於AFP、AFP- L3和DCP均為陽性的HCC亞組,手術切除治療的患者具有顯著的生存優勢(5年OS 74.9% vs. 47.6%,P<0.01)。作者認為多種HCC標誌物的存在與較差的生物學特性、MVI和微衛星病變風險增加相關。因此作者預測,與手術切除相比,RFA消融邊緣導致相對較低的根治性腫瘤清除率。
MVI影響肝移植患者選擇和預後
腫瘤的大小和數量歷來是肝移植預後評估的基準,但研究表明結合腫瘤級別、衛星灶和MVI等生物標誌物可以大大提高預後的準確性。Mehta 等開發了移植後腫瘤複發風險評估(RETREAT)標準,即基於三個腫瘤特徵:移植時AFP水準、MVI狀態、最大存活腫瘤數與外植體腫瘤數量之和。與隻考慮腫瘤大小和數量的米蘭標準相比,RETREAT標準預測移植術後複發更為準確。
Mazzafro等對1112例超出米蘭標準移植患者的研究表明,無論腫瘤大小或數量,MVI的存在使所有的HRs翻倍(5年OS為33%),而MVI陰性且符合UP-to-7標準的患者生存率與符合米蘭標準的患者相似(5年OS為71.2%)。基於此研究,在超出米蘭標準的MVI陽性HCC患者中進行移植與不良結局相關,應該避免進行移植。
MVI陽性HCC的治療
新輔助抗病毒治療 & TACE輔助治療
多項研究表明HBV陽性的HCC患者(HBV-HCC)MVI發生率高,且侵襲程度與HBV病毒DNA載量相關。上海東方肝膽醫院沈鋒教授帶領研究團隊評估了新輔助HBV抗病毒治療(AVT)對進行根治性肝切除術的HBV-HCC患者MVI發生率的影響。與非AVT組相比,新輔助AVT組可顯著降低MVI發生率(38.7% vs. 48.6%,P=0.001)及2年複發率(38.5% vs. 52.3%,P<0.001)。此外,多項研究顯示,MVI陽性HCC患者根治性切除術後進行TACE輔助治療亦可降低術後早期複發率,延長患者生存期。
MVI的限制性與未來發展方向
軸位顯像、血清和組織標誌物是無創MVI檢測的未來發展方向
MVI有助於醫生做出更明智的治療決策,提高患者預後。但目前確定MVI只能通過組織病理學評估,空芯針穿刺活檢對MVI缺乏敏感性,臨床迫切需要一種可靠的無創檢測方法。基於CT、MRI和PET/CT的軸位成像是無創MVI檢測的一種新方法,與活檢相比,軸位顯像對患者的風險較低,可以對整個腫瘤和肝臟進行可視化,提供更完整的疾病負荷評估。除了軸位顯像外,血清和組織標誌物也可預測MVI狀態。
總結
MVI是影響HCC手術切除和肝移植術後早期複發的決定性因素,比傳統的腫瘤分期標準更能精確的預測患者長期生存。MVI的檢測對手術切除、消融、肝移植術均具有重要指導意義。對MVI陽性HCC患者進行積極綜合乾預尤為重要。遺憾的是,目前MVI只能根據術後標本來確定,限制了其指導個性化治療的潛在價值。分子生物技術和成像技術有望為可靠且無創檢測MVI提供新方法,並對HCC的治療產生顛覆性和有益的影響。


參考文獻
1. Erstad DJ & Tanabe KK. Prognostic and Therapeutic Implications of Microvascular Invasion in Hepatocellular Carcinoma. Ann Surg Oncol. 2019 Feb 20.
2. Feng LH, et al. Novel microvascular invasion-based prognostic nomograms to predict survival outcomes in patients after R0 resection for hepatocellular carcinoma. J Cancer Res Clin Oncol. 2017 Feb;143(2):293-303.
了解更多
MA-NEX-CN-0069-1