6月20日,國家衛健委藥物政策與基本藥物制度司發布《第一批鼓勵仿製藥品目錄建議清單》,總計34個藥品,包含多個抗癌藥和罕見病藥物。
該清單為國家衛生健康委聯合科技部、工業和信息化部、國家葯監局、知識產權局等部門組織專家對國內專利到期和專利即將到期尚沒有提出註冊申請、臨床供應短缺(競爭不充分)以及企業主動申報的藥品進行遴選論證,提出了具體清單,公示為5個工作日。
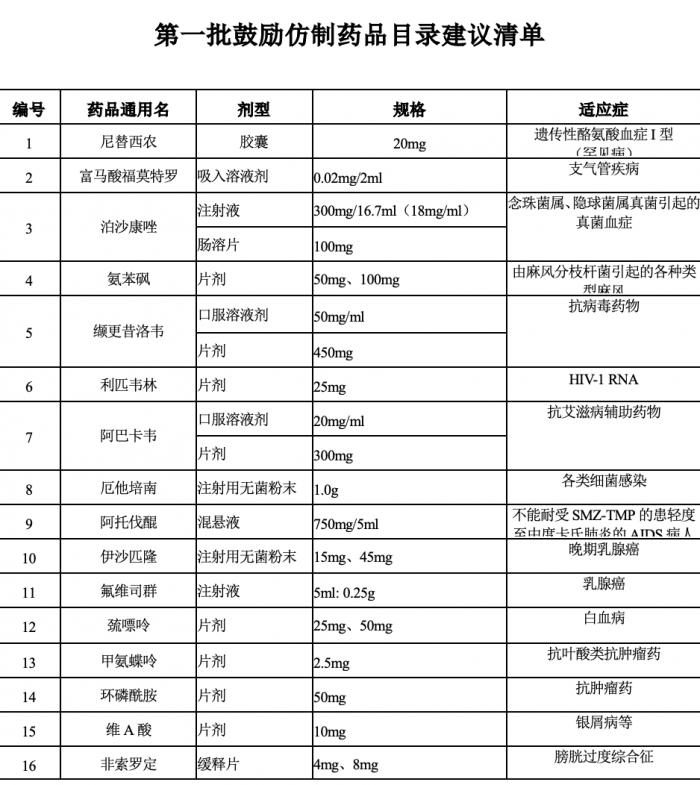

(圖源:國家衛健委,適應症為21世紀經濟報導記者整理)
抗癌藥一向是重點,罕見病藥物也成為今年國家重點發力對象。
2月23日,財政部等四部門發布《關於罕見病藥品增值稅政策的通知》,從3月1日起,對首批21個罕見病藥品和4個原料葯,國內環節可選擇按照簡易辦法依照3%徵收率計算繳納增值稅,進口環節減按3%徵收增值稅。
由於罕見病的特殊性,單個罕見病病種,無論在新葯研發還是臨床治療都面臨諸多挑戰。很多罕見病認識水準低、誤診率高、藥物可及性差;罕見病藥物公司也面臨著投入高、研發難、上市難的風險;對於一些罕見病患者來說,無葯可醫、有葯價高、難進醫保、甚至進了醫保可能也買不到葯都是常態。
由於藥品金貴、價格高昂,鼓勵仿製葯合情合理。
生而罕見
罕見病不是一種疾病,目前中國尚未有官方的罕見病定義。
各國對罕見病的定義和標準不一:罕見病在美國是患病人數低於20萬人的疾病;在歐盟是患病率低於1/2000的疾病;在日本是患病人數低於5萬人的疾病。
全世界已知的罕見病約有7000種,按照五十萬分之一發病率測算,預估我國罕見病患者總數不低於2500萬。
大多數罕見疾病都是遺傳性疾病,即使癥狀沒有立即出現,可能會伴隨一個人的整個生命。EURORDIS數據稱個別罕見疾病可能隻影響一百萬人中的一人,但所有罕見疾病患者共佔歐盟人口的6%至8%。
罕見病的首要困難是難診斷。以脊髓性肌萎縮症(SMA)為例,這是一種被稱為「2歲以下嬰幼兒頭號遺傳病殺手」的罕見病,患者脊髓內的運動神經細胞受到侵害後,會逐漸喪失各種運動功能,甚至呼吸和吞咽。
很多兒科醫生都對它知之甚少,甚至有些神經科醫生也不一定能做出準確診斷,導致誤診率居高不下。一旦不幸確診,患兒和家庭還將繼續面臨無葯可用的窘境,家長只能從護理和營養上維持和改善患兒的器官功能。
EURORDIS在2008年發起並確定了2月29日為國際罕見病日,四年一次的日子意寓罕見病之「罕見」,後將每年二月的最後一天定為國際罕見病日。
其次的困難是「無葯可用」。
治療罕見病的藥物又叫孤兒葯,由於患者太少,在正常的市場條件下,無法靠銷售回收前期高額的研發投入,製藥公司對開發僅針對少數患者的產品幾乎沒有興趣。
此前在第七屆中國罕見病高峰論壇上,國家衛健委罕見病診療與保障專家委員會副主任委員丁潔表示,一方面,對罕見病發病機制研究不足,對治療靶點的研究也不夠;第二,企業對罕見病藥物的開發動力不足;第三,由於患病人群少,難以找到足夠數量的病人開展相關臨床試驗,無法滿足藥品上市的要求。
對此各國在針對孤兒葯的研發上都做出了不同程度的鼓勵,美國在1983年通過的孤兒葯法案對其研發進行了經濟上的激勵,包括研發成本的50%稅收抵免、孤兒藥專營權排他性條款等。進而影響了日本在1993年、歐盟在2000年制定了相關的政策。
「中國罕見病整體行業發展起步比較晚,政策上現在還沒有一部全國性的罕見病法規。」罕見病發展中心(CORD)創始人、主任黃如方此前在接受21世紀經濟報導採訪時表示,2009年之前在國內是被忽視的狀態,「09年我們引入了罕見病日、做了大量的宣傳;09年至2014年期間,是罕見病被廣泛關注的時期,孵化出了大量的罕見病患者組織,臨床專家也越來越正視罕見疾病患者群體。」
但公眾仍然對罕見病有一些誤區,如覺得離自己很遙遠而不關心,患者太少可以忽略,「還有一些誤解覺得罕見病藥物都特別貴,一個病人佔了很多醫療支出,但罕見病人首先面臨的是無葯可醫,有藥用了不能用價格來衡量,應該是用價值來衡量。每一個人都應該有基本的醫療的保障,在價格問題上可以通過多方努力去解決。」
2014年出現了冰桶挑戰賽,讓漸凍人成為最為著名的罕見病病種。僅在美國就有170萬人參與挑戰,250萬人捐款,總金額達1.15億美元,這可能是為某種疾病或緊急情況捐助最多的款項。
2015年,中國成立了罕見病專家委員會,「從15年到現在是政策陸續頒布的階段,我樂觀估計到2020年,罕見病的產業會得到較大的發展。」
2018年4月,國家衛生健康委員會等5部門聯合制定了《第一批罕見病目錄》,包含121種罕見病。據不完全統計,僅44個病種有相關藥物在全球上市,多數疾病還處於無葯可治的狀態。10月,葯監局發布罕見病防治醫療器械註冊審查指導原則。包括依庫珠單抗、艾美賽珠單抗等多個罕見病藥物加速獲批上市。2019年2月,國家衛健委發布了建立全國罕見病診療協作網的通知。
「能看出國家對於罕見病問題,特別是患者臨床用藥是下了決心要解決的。」黃如方說,「督促各個部委如衛健委、葯監局、科研系統、醫保部門陸續頒布一系列政策。」
黃如方認為,可以預見到的是,未來幾年,「一是國外的罕見病藥物將會井噴式進入中國市場,特別是國家目錄裡相對應治療的疾病。二是會激勵中國醫療產業對於罕見病藥物的防治和創新研發。三是加快罕見病患者的診斷、更加規範的治療。四是解決患者可及可負擔問題,醫保部門會在罕見病藥品的報銷有更明確的舉措。」
藥物罕見
罕見病藥物罕見,價格自然也金貴。
EvaluatePharma《Orphan Drug Report 2018》數據顯示,預計從2018年到2024年,全球孤兒葯銷售將以11.3%的複合年增長率增長,是非孤兒葯市場6.4%的兩倍;預計到2024年,孤兒葯將佔全球處方葯銷售額的五分之一,達到2620億美元。
儘管最近兩年孤兒葯的定價增長有所放緩,但2017年每位患者的平均成本仍然達到了147308美元,是非孤兒葯的平均成本30708美元的四倍多。
2017年,Revlimid通過了多發性骨髓瘤適應症、獲得孤兒藥品的資格,Celgene成為擁有最大孤兒葯銷售量的公司。陣發性夜間血紅蛋白尿治療的年度價格超過50萬美元,Soliris成為行業最昂貴的藥物。
到2024年,預計腫瘤佔比最大的孤兒藥物治療領域,約佔50%,血液為第二大治療領域,其次為中樞神經系統。Celgene也將成為2024年孤兒葯市場的領先企業,銷售額為184億美元,如BMS收購新基成功,這一名號也將易主;預計Keytruda將成為2024年的孤兒葯銷售冠軍,銷售額為127億美元,Revlimid滑到第二位,預計銷售額為119億美元。
監管部門也不斷頒布鼓勵措施,往年FDA獲批的腫瘤葯也是最大頭,但今年「孤兒葯」強勢勝出,59種新葯中有34種(58%)是針對罕見疾病的,創下了歷史記錄。
由此吸引進入行業的玩家也越來越多。2019年1月8日,武田製藥完成對罕見病公司夏爾(Shire)的收購,交易金額約624億美元。
羅氏中國神經學領域臨床科學家張巍峰此前在罕見病論壇上表示,2017年羅氏研發總投入106億美元,其中相當一部分投在罕見病領域。「目前進入臨床研發及上市階段的罕見病藥物總共9個,覆蓋超過10種罕見病,已經完成和正在進行的臨床實驗超過50項。」
但除了研發,罕見病藥物的準入、上市後如何提高可及性也是難題。
張巍峰表示,「當臨床實驗的結果交到國家藥品監督管理局的時候,由於這些數據相對比較貧乏,不像糖尿病、高血壓有幾萬人的數據,罕見病一般只有幾十人的數據。要做出一個有效的、正確的判斷,本身也是一個很困難的過程。」
在美國,「很多小型生物製藥公司在罕見疾病藥物的研發前期階段,會得到非常多的公共資源支持。」黃如方介紹,如果沒有政策優惠,研發難以為繼,美國最大的亨廷頓舞蹈症基金會每年投入數千萬美元進行科研,「很多錢都是打水漂的,亨廷頓舞蹈症現在仍然沒有治療藥物,基礎研究一定需要公共資源去投入。罕見病的產品到臨床階段才可能掙錢。歐美很多小的孤兒葯公司當藥物到臨床階段就賣給大公司。中國現在非常薄弱的環節是公共資源的投入非常少,到底能募集到多少公共資源去投入到藥物前期研發階段,我們自己也在思考這個問題。」
另外,也會出現一些「中國特色的問題」,比如一些藥物進入國內後沒有相應的罕見病適應症獲批;進了醫保但在醫院買不到葯,黃如方說,「都是因為中國醫療體制和政策的問題,比如對於葯佔比的過度考核導致很多罕見病藥物在一些醫院買不到;一些疾病需要門診治療,但是政策規定可能住院治療才能報銷。」
在罕見病救助和保障方面,我國各地方政府也正在因地製宜地摸索出各種特色模式。罕見病發展中心(CORD)高級顧問、青島市社會保險研究會副會長劉軍帥介紹,在罕見病領域,我國已有很多地方探索出很多模式,比如浙江模式、青島模式,這些模式都是由當地政府主導,部分病種多方共付的模式。具有政府多部門聯動、社會多方資源共享的特點,這樣患者在報銷後,自己支付的費用在承受範圍內,最大程度減輕患者經濟負擔。
「醫療保障制度最關鍵在於公平和可持續。」劉軍帥認為,一方面可以將社會保險與慈善相結合,提高罕見病葯報銷比例;另一方面,針對罕見病醫保報銷制定出獨立的罕見病政策,單獨籌資單獨支付。醫保三大要素,籌資、待遇、付費,三者均需獨立。「罕見病醫療保障是一個倫理問題,少數人的生命也是生命,所以必須給予良好的福利政策;但是,如果與其他病放在同一個體系裡,公平性問題必然繞不開,所以需要獨立籌資獨立運作。」








