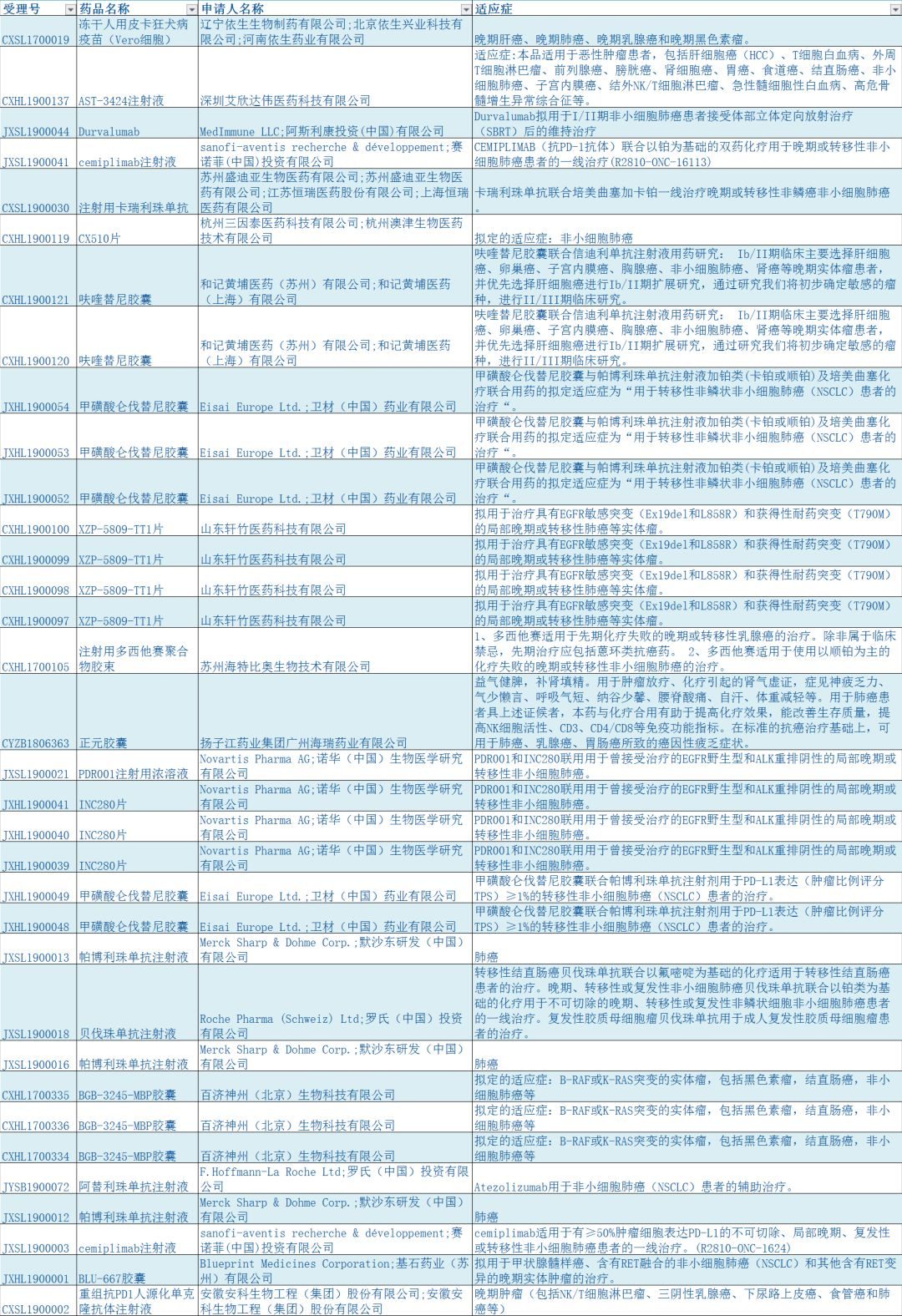
▎葯明康德/報導
默沙東(MSD)今日宣布,FDA接受了該公司為重磅免疫療法Keytruda(pembrolizumab)遞交的補充生物製劑許可申請(sBLA)。申請Keytruda作為單葯一線療法,治療無EGFR和ALK癌症基因變異,表達PD-L1(腫瘤比例評分[TPS]≥1%)的局部晚期或轉移性非小細胞肺癌(NSCLC)。FDA同時授予該申請優先審評資格,並預計在2019年1月11日之前做出回復。

肺癌是全球癌症患者的最主要死因之一。每年由於肺癌去世的人數,比由於結腸癌、乳腺癌、以及攝護腺癌而去世人數的總和還要多。肺癌主要分為非小細胞肺癌(NSCLC)和小細胞肺癌。NSCLC約佔肺癌總病例的85%。在美國,肺癌在確診後的5年生存率只有18%,治療前景不容樂觀。

▲Keytruda的作用機理(圖片來源:Keytruda官網)
Keytruda作為一款重磅免疫療法,已展現出了廣泛的治療潛力,成為默沙東的主打免疫療法。它可以選擇性阻斷PD-1與其配體PD-L1和PD-L2結合,使T淋巴細胞識別並殺死癌細胞。Keytruda已被批準用於多種癌症的治療,如黑色素瘤、肺癌、頭頸癌、經典霍奇金淋巴瘤、原發性縱隔大B細胞淋巴瘤、尿路上皮癌、微衛星不穩定性高(MSI-H)癌症、胃癌、和晚期宮頸癌。
此次申請是基於默沙東的KEYNOTE-042關鍵臨床3期試驗。試驗結果顯示,Keytruda作為單葯一線療法,在多個患者群體中都顯著延長了總生存期(OS),且療效隨著PD-L1表達水準的提高而上升。在PD-L1表達水準大於50%的患者群體裡,化療組的中位OS為12.2個月,而Keytruda組OS為20.0個月,提升幅度超過60%。KEYNOTE-042是Keytruda用於治療NSCLC的5個3期試驗之一,其結果發布在2018年美國臨床腫瘤學會(ASCO)年會上。

▲默沙東研究實驗室的首席醫學官、高級副總裁兼全球臨床開發負責人Roy Baynes博士(圖片來源:默沙東公司官方網站)
默沙東研究實驗室的首席醫學官,高級副總裁兼全球臨床開發負責人Roy Baynes博士說:「Keytruda已經成為治療轉移性NSCLC的基石。默沙東對FDA正在評估此次遞交的sBLA感到非常高興,我們期待拓展Keytruda作為單葯療法的適應症範圍,治療PD-L1表達水準大於1%的,局部晚期或轉移性NSCLC。」
參考資料:
[1]. FDA Grants Priority Review to Merck』s Application for KEYTRUDA? (pembrolizumab) Monotherapy for First-Line Treatment of Locally Advanced or Metastatic Non-Small Cell Lung Cancer in Patients Whose Tumors Express PD-L1 (TPS ≥1%). Retrieved September 12, 2018, from https://www.mrknewsroom.com/news-release/oncology/fda-grants-priority-review-mercks-application-keytruda-pembrolizumab-monothera
[2]. ASCO復盤:這些最新抗癌進展,你都知道嗎. Retrieved September 12, 2018, from https://mp.weixin.qq.com/s/CDayb3JCbNEAOHkFEC3qgg
本文來自葯明康德微信團隊,歡迎轉發到朋友圈,謝絕轉載到其他平台;如有開設白名單需求,請在文章底部留言;如有其他合作需求,請聯繫[email protected]